Допустимые и недопустимые контакты металлов. Популярные метрические и дюймовые резьбы / Хабр
Электронику часто называют наукой о контактах. Многие знают, что нельзя скручивать между собой медный и алюминиевый провода. Медная шина заземления или латунная стойка для платы плохо сочетаются с оцинкованными винтиками, купленными в ближайшем строительном супермаркете. Почему? Коррозия может уничтожить электрический контакт, и прибор перестанет работать. Если это защитное заземление корпуса, то прибор продолжит работу, но будет небезопасен. Голая алюминиевая деталь вообще может постепенно превратиться в прах, если к ней приложить даже низковольтное напряжение.
Доступные нам металлы не ограничиваются только медью и алюминием, существуют различные стали, олово, цинк, никель, хром, а также их сплавы. И далеко не все они сочетаются между собой даже в комнатных условиях, не говоря уже о жёстких атмосферных или морской воде.
В советских ГОСТах было написано почти всё о допустимых контактах металлов, но если изучение чёрно-белых таблиц из 1000 ячеек мелким шрифтом утомляет, то правильный ответ на «медный» вопрос — нержавейка, либо никелированная сталь, из которой, кстати, и сделан почти весь «компьютерный» крепёж. В эпоху чёрно-белого телевидения были другие понятия об удобстве интерфейса, поэтому для уважаемых читателей (и для себя заодно) автор приготовил цветную шпаргалку.
В эпоху чёрно-белого телевидения были другие понятия об удобстве интерфейса, поэтому для уважаемых читателей (и для себя заодно) автор приготовил цветную шпаргалку.
И, раз уж зашла речь о металлообработке, заодно автор привёл таблицу с популярными в электронике резьбами и соответствующими свёрлами, отобрав из объёмных источников наиболее релевантное по тематике портала. Не все же здесь слесари и металлурги, экономьте своё время.
Преамбула
Да, в век 3D-печати популярность напильника с лобзиком несколько потускнела. Но клетка Фарадея для РЭА по-прежнему является преимуществом, не забываем и про защитное заземление. Да, для печати корпусов РЭА уже доступен электропроводный (conductive) ABS-пластик, но судя по источнику, его удельное сопротивление примерно в миллион раз больше меди. Дескать, пыль уже не липнет, но для заземления всё равно многовато. Напечатать же стальные детали корпуса ПК в домашних условиях пока никак невозможно, да мы и алюминий-то с оловом никак не освоим…
Что же делать? Нашему брату приходится действовать методом Микеланджело, используя для творчества вместо каменной глыбы купленные в DIY-магазине заготовки, либо вообще старые корпуса ПК. Работая как-то с корпусом от старого сервера IBM из шикарной миллиметровой стали, автор впал в ступор, потому что имеющаяся резьба была крупнее М3, но мельче #6-32 (позже выяснилось, что это М3,5). Зачем вообще понадобилось в 2003-м году использовать метизы М3,5, останется загадкой, но о существовании дробной метрической резьбы автор даже не подозревал.
Работая как-то с корпусом от старого сервера IBM из шикарной миллиметровой стали, автор впал в ступор, потому что имеющаяся резьба была крупнее М3, но мельче #6-32 (позже выяснилось, что это М3,5). Зачем вообще понадобилось в 2003-м году использовать метизы М3,5, останется загадкой, но о существовании дробной метрической резьбы автор даже не подозревал.
UPD
Для моддеров, кстати, рынок предлагает новые, удобные инструменты арсенала домашней мастерской, и про один из них (осциллорез) я рассказываю в отдельной публикации. Арсенал принадлежностей прекрасно дополнит более привычные циркулярные мини-пилы (aka «дремели»), а отсутствие эффекта «запрессовки зубьев» упростит обработку вязких металлов типа меди и алюминия. Инструмент лёгкий, не такой неуклюжий и опасный, как «болгарка». Можно пилить металл практически на уровне носа и без риска получить рубящий удар от заклинившего или осколок от «взорвавшегося» диска. А так бывает в красочно описанных уважаемыми читателями случаях с УШМ: 300-граммовый блин «болгарки» делает 200 оборотов в секунду, потребляя до 2кВт электричества, и требует чуть ли не костюм сапёра.
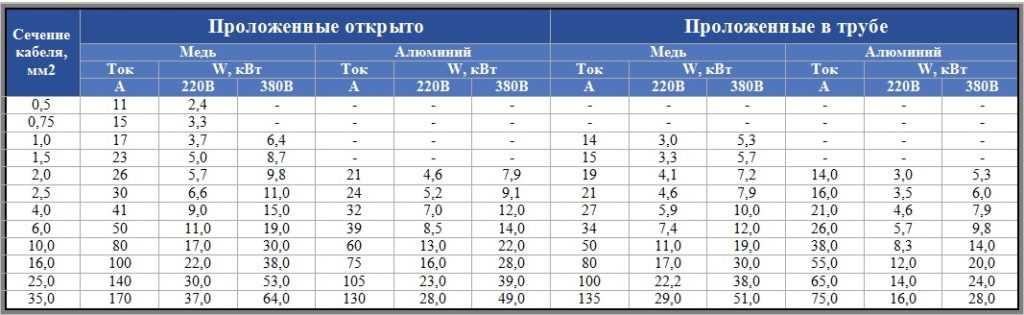
Допустимые и недопустимые контакты металлов по ГОСТ 9.005-72
DISCLAIMER: Предоставляется «как есть». Если уважаемый читатель занимается моделизмом, автомобилизмом или робототехникой, в ГОСТе также приведены: Таблица №2 для жестких и очень жестких атмосферных условий, Таблица №3 для контактов, находящихся в морской воде. Ниже я предлагаю выдержку из Таблицы №1 для средних атмосферных (т.е. комнатных) условий. Буква «А» означает «ограниченно допустимый в атмосферных условиях», подробности в самом ГОСТе.
Кликабельно (спасибо, НЛО):
UPD:
для средних атмосферных условий
для жестких и очень жестких атмосферных условий
Пара слов о металлах
Металлурги, поправляйте, если что не так. Коррозия очень объёмная и сложная тема, и я не претендую на полноту её освещения. Я лишь даю выборочные зарисовки, чтобы сформировать у читателя нужные ассоциативные ряды.
Коррозия очень объёмная и сложная тема, и я не претендую на полноту её освещения. Я лишь даю выборочные зарисовки, чтобы сформировать у читателя нужные ассоциативные ряды.
Оцинковка
Оцинкованная сталь — основная рабочая лошадка народного хозяйства. В виде различных метизов «оцинковка» встречается в магазинах стройматериалов гораздо больше, чем, например, «премиумная» нержавейка. Фабричные корпуса ПК, технологические ящички и шкафчики для оборудования чаще всего выполнены из оцинкованной холоднокатанной стали толщиной порядка 1мм (чем дешевле корпус, тем тоньше лист). «Оцинковка» достаточно прочна и хорошо проводит ток, в промышленности требуется заземление. Если разрезать корпус, то под слоем краски какого-нибудь унылого RAL7035 будет тончайшее цинковое покрытие, а под ним, скорее всего, та самая углеродистая холоднокатанная сталь. Лично у меня нет причин не доверять ГОСТ 9.005-72, поэтому после колхозинга фабричных изделий вообще не рекомендую делать электрический контакт на месте среза стали, лучше постарайтесь сберечь цинковое покрытие.
Алюминий
Алюминий и его сплавы бывают анодированные (с защитным слоем) и обычные (неанодированные). Алюминий легко обрабатывать в домашних условиях, но помните о коррозии. Не используйте голый алюминий в качестве проводника даже с низковольтным напряжением, иначе ток медленно обратит деталь в прах. Обработанным в мастерской алюминиевым и дюралюминиевым деталям показана полная
 Для простоты можно принять, что при контакте с другими металлами и покрытиями алюминий будет корродировать сам по себе, без помощи внешнего электричества.
Для простоты можно принять, что при контакте с другими металлами и покрытиями алюминий будет корродировать сам по себе, без помощи внешнего электричества.Витая пара из омедненного алюминия (Copper Clad/Coated Aluminium, CCA) — это отдельная история, в домашних условиях кабель всё равно не производится.
Медь
Медь мягкая и довольно неаппетитно окисляется на воздухе, поэтому изделия из меди заключают в герметичную оболочку или лакируют. Латунные бляхи солдатских ремней и стойки для электронных печатных плат лучше сопротивляются окислению и выглядят аппетитнее позеленевшей меди, особенно если их периодически полировать (я про бляхи, конечно). При этом ни медь, ни её сплав с цинком (латунь) «не дружат» с чистым цинком и его покрытиями. Зато медь совмещается с хромом, никелем и нержавейкой. А если вы держите в руках какую-нибудь клемму, то она наверняка из лужёной (покрытой оловом) меди.
Олово
Олово мягкое, но зато стойкое к коррозии (в комнатных условиях) и электрически совместимое почти со всеми, кроме чугуна, низколегированных и углеродистых сталей, магния.
UPD:
На холод изделие выносить нельзя, а при минусовых температурах лучше не эксплуатировать вообще.
Никель
Никелем покрыты блестящие «компьютерные» винтики. Такое покрытие совместимо с медью и бронзой, латунью, оловом, хромом и нержавеющей сталью. Никель несовместим с цинком и алюминием (для алюминия лучше контакт с нержавеющей сталью, см. ниже).
Нержавейка
Нержавеющая сталь — королева металлов сталей: прочная, пластичная, стойкая к коррозии, электропроводная, круто выглядит. Слишком тугая, чтобы резать и гнуть её дома в промышленных масштабах. Хромистые и хромисто-никелевые нержавейки электрически плохо совместимы с цинком и «голой» сталью, зато дают надёжный контакт с медью без помощи олова.
Пара слов про case modding
Если вы занимались сборкой ПК, то наверняка знаете, что болтики для монтажа приводов CD/DVD, «ноутбучных» дисков 2.5″ и флоппи-дисководов (ха-ха) используют метрическую резьбу M3. В корпусах ПК и жёстких дисках 3.5″ используется более грубая дюймовая резьба #6-32 UNC. Почему? Мягкий металл любит более грубую резьбу, к тому же адепты дюймовой системы пока лидируют на рынке технологий. Стойка 19″ использует (вы не поверите) дюймы в качестве основной меры, однако для монтажа оборудования я встречал только оцинкованные клетевые шайбы и винты с метрической резьбой М6. Дюймово-метрический дуализм в технологиях…
Обустройство своей инженерной кухни я начал с того, что купил защитные очки, набор качественных свёрл по металлу, небольшой вороток и метчики на резьбы M3 и #6-32 UNC, а заодно M4 и M6. Плашки не понадобились.
Плашки не понадобились.
Популярые виды резьбы, используемой в компьютерной технике
ГОСТ 19257-73 рекомендует использовать следующие диаметры свёрл для металлов. Наверное, стоит учитывать и количество метчиков в наборе: чем твёрже материал, тем больше необходимость в «предварительных» метчиках. У меня их по три штуки, два «грубых» и один «финишный». А как правильно, кстати?
UPD
А как правильно — читайте комментарии, на публикацию-таки зашли мастера слесарного дела, только я не успел отсортировать всю информацию. Пользователь golf2109 любезно принёс сюда прямо из мастерской два правых столбца таблицы для обозначения того, как мягкость (вязкость) металла влияет на диаметр отверстия под резьбу, благодарю за поддержку.
| Диаметр резьбы | Стандартный шаг, мм | Диаметр сверла, мм | ||
| ГОСТ | Fe | Al | ||
| M2 | 0. 4 4 |
1,6 | 1.5* (-0.1) | |
| M2,5 | 0.45 | 2.0 | 1.8* (-0.2) | |
| M3 | 0.5 | 2.5 | 2.3 (-0.2) | |
| M3.5 | 0.6 | 2.7* (-0.2) | ||
| M4 | 0.7 | 3.3 | 3.2 | 3.0 (-0.3) |
| M5 | 0.8 | 4.2 | 3.9 (-0.3) | |
| M6 | 1.0 | 5.0 | 4.9 | 4.6 (-0.4) |
| M8 | 1.25 | 6.8 | 6.7 | 6.3 (-0.5) |
| M10 | 1.5 | 8.5 | 8.0 (-0.5) | |
| #6-32 UNC | 0.794 | 2.85 | 2.7* | 2.5* (-0.35) |
* Я рискнул прикинуть калибры двух дополнительных свёрл для стали и алюминия там, где по ним у меня нет данных в источниках.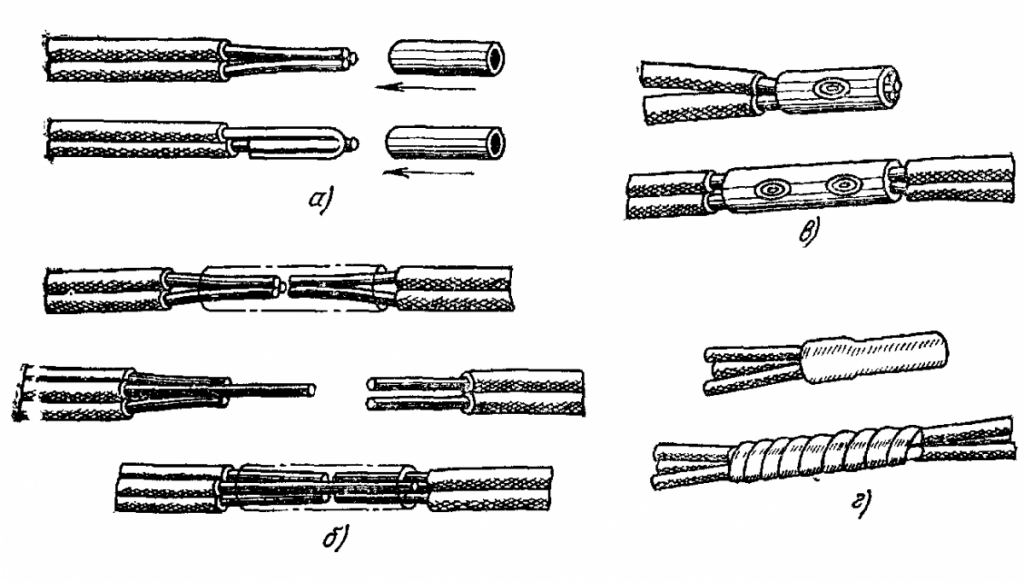 Обратите внимание, резьба #6-32 UNC по наружному диаметру находится между M3 и M4, а по шагу резьбы вообще ближе к M5.
Обратите внимание, резьба #6-32 UNC по наружному диаметру находится между M3 и M4, а по шагу резьбы вообще ближе к M5.
UPD
Если сверлите что-то толще миллиметрового листа, читайте спойлер про СОЖ.
про СОЖ
Довольно большое значение и при сверлении, и при нарезании резьб имеет смазка и охлаждение обрабатываемых деталей и инструмента. Настоятельно рекомендую при подаче сверла не спешить и пользоваться техническими жидкостями. Режущая кромка сверла легко перегревается от сухой детали, и получается металлический отпуск. Поверьте, такой отпуск не нужен: он вызывает необратимые изменения в структуре металла и деградацию его прочностных свойств (сверло тупится гораздо быстрее, чем должно). Что делать? Вот несколько советов, которые автор встречал в разных местах.
Не сверлите большим сверлом сразу, разбейте операции примерно по 3мм: т.е. отверстие 10мм сперва проходим 3мм, потом 6мм.
Хорошенько отметьте отверстие керном. Одолжите у ребёнка пластилин, сделайте бортик вокруг планируемого отверстия так, чтобы получился мини-бассейн размером с монету. Если под рукой нет *вообще ничего*, хорошенько смешайте ложку подсолнечного масла с ложкой жидкого мыла и налейте в этот мини-бассейн, хуже не будет. Но если нужно просверлить насквозь, скажем, гирю 16кг, погуглите книгу народных рецептов «сож своими руками». Желаю всем начинающим удачной пенетрации: как говорится, берегите ваши свёрла-метчики смолоду, ведь их ждут новые идеи и интересные изобретения!
На известной китайской площадке можно приобрести «пальцевые» винтики (thumb screw), причём и на #6-32, и на M3. Материал и цвет разный.
Источники
» ГОСТ 9.005-72. Единая система защиты от коррозии и старения. Машины, приборы и другие технические изделия. Допустимые и недопустимые контакты металлов. Общие требования.
» ГОСТ 19257-73. Отверстия под нарезание метрической резьбы.Диаметры.
» Unified Coarse Thread ANSI B1.1 (резьбы UNC ANSI B1.1).
Мир современных материалов — Защитные покрытия для электрических контактов алюминий-медь
- Информация о материале
- Опубликовано: 02 июля 2014 02 июля 2014
- Просмотров: 12638 12638
Окружающая среда оказывает существенное влияние на работу электрических контактов. В случае контакта между разнородными металлами (частый случай – контакт меди и алюминия), имеющими разные электрохимические потенциалы, при взаимодействии содержащихся в атмосфере различных оксидов (СО2, SO2 и др.) с влагой воздуха образуются растворы кислот, которые являясь электролитом, вызовут гальванический процесс между электродами контактной пары. Электрохимическая коррозия приведет к постепенному разрушению контактного соединения.
Для предотвращения коррозии и повышения стабильности соединений медь-алюминий широко применяют нанесение покрытий на один или оба контактирующие элемента. Наиболее часто используются олово, серебро, медь, никель.
Наиболее часто используются олово, серебро, медь, никель.
Исследования и практика эксплуатации показали, что покрытия из олова не предотвращают гальванической коррозии и не гарантируют стабильность электрических характеристик контакта медь-алюминий. Во-первых, такие покрытия восприимчивы к фреттингу, вызывающему деградацию поверхности контакта, повышение и нестабильность контактного сопротивления. Во-вторых, олово даже при комнатной температуре легко формирует интерметаллические соединения с медью, отличающиеся хрупкостью, высоким сопротивлением и чувствительностью к воздействию окружающей среды. В связи с этим для уменьшения коррозионного повреждения целесообразно дополнительно использовать контактные смазки.
Покрытия из серебра широко используются в контактах коммутационной аппаратуры закрытого типа, эксплуатирующихся при высоких температурах. Их наносят преимущественно электрохимическим методом, а также методом горячего погружения в расплав. Серебряные покрытия должны быть однородными и относительно толстыми — для закрытой коммутационной аппаратуры и шин оптимальной считается толщина покрытия 5-15 мкм. Однако в случае работы контактов в условиях многократных переключений, или при высоких требованиях к стабильности контактного сопротивления толщина наносимого покрытия должна быть еще больше.
Серебряные покрытия должны быть однородными и относительно толстыми — для закрытой коммутационной аппаратуры и шин оптимальной считается толщина покрытия 5-15 мкм. Однако в случае работы контактов в условиях многократных переключений, или при высоких требованиях к стабильности контактного сопротивления толщина наносимого покрытия должна быть еще больше.
Но и серебро обладает рядом недостатков: оно является электроотрицательным к алюминию, вызывая его коррозию; склонность к потускнению, пористость покрытий делает их чувствительными к повышенной влажности.
Медь — металл красноватого цвета, очень дефицитный, так как его содержание в земной коре составляет не более 4,7-10-3 % (в верхней ее части примерно 2-10-3%). Этот металл получил широкое распространение в качестве проводникового материала, поскольку обладает целым рядом технически ценных свойств: высокой электропроводностью и достаточно механической прочностью; удовлетворительной стойкостью к коррозии даже в условиях повышенной влажности; хорошей обрабатываемостью.
Никель относится к одним из наиболее распространенных элементов в земной коре. Высокая стойкость к окислению и коррозии, относительно низкое сопротивление и коэффициент термического расширения, высокая механическая прочность никеля и его сплавов обусловили их широкое применение в электротехнике. Даже в холодном состоянии никель легко поддается механической обработке.
Покрытия из никеля являются лучшими в сравнении с другими, как с экономической точки зрения, так и улучшения контактных свойств соединений алюминий-медь. Сравнительные испытания покрытий олова, серебра, никеля и меди в таких соединениях были проведены Брауновичем. Количественная оценка способности покрытий к защите от коррозии при воздействии солевых растворов и индустриально загрязненной атмосферы приведена в табл. 1. Показатель эффективности определялся усреднением показателей, характеризующих работу соединения в условиях действия различных факторов (циклическое изменение тока, фреттинг, действие солей и индустриальных загрязнений).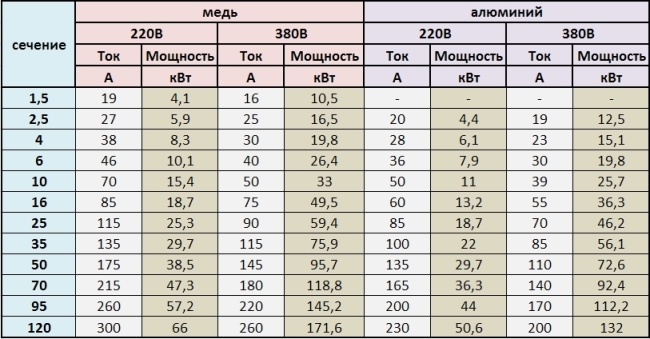 Чем ниже величина показателя, тем выше эффективность материала покрытия.
Чем ниже величина показателя, тем выше эффективность материала покрытия.
Таблица 1. Сравнительная оценка эффективности различных покрытий для соединения алюминий—медь [1].
|
Контактная пара |
Показатель эффективности |
|
Алюминий (покрытие никеля) — медь (покрытие никеля) |
0,7 |
|
Алюминий (покрытие меди) — медь (без покрытия) |
1,0 |
|
Алюминий (без покрытия) — медь (покрытие никеля) |
1,3 |
|
Алюминий (без покрытия) — медь (покрытие серебра) |
2,0 |
|
Алюминий (без покрытия) — медь (без покрытия) |
2,4 |
|
Алюминий (без покрытия) — медь (покрытие олова) |
2,7 |
Как следует из табл. 1, наилучшим металлом для защитных покрытий контактов алюминий-медь является никель или медь, нанесенная на поверхность алюминия.
1, наилучшим металлом для защитных покрытий контактов алюминий-медь является никель или медь, нанесенная на поверхность алюминия.
Литература:
1. Мышкин Н.К., Кончиц В.В., Браунович М. Электрические контакты. – Издательский дом «Интеллект», 2008. – 560 с.
Source: http://www.worldofmaterials.ru/spravochnik/conductors/21-kompozitsionnye-kontaktnye-materialy
Вас также может заинтересовать:
- Антикоррозийные покрытия
- Назад
- Вперед
Гальваническая коррозия алюминия
Следует подчеркнуть, что стойкость алюминия и алюминиевых сплавов к нормальным условиям окружающей среды очень высока. Основным источником защиты от коррозии является прочная самовосстанавливающаяся оксидная пленка, которая всегда присутствует на алюминии в атмосфере окружающего воздуха (рис. 1).
Рисунок 1 – Естественная защита алюминия от коррозии – поверхностная оксидная пленка [4]
Основные виды коррозии алюминия
Для коррозии алюминия характерны следующие основные виды [4]:
- общая коррозия
- щелевая коррозия
- Фреттиниг-коррозия
- Коррозия под напряжением
- Гальваническая коррозия
- Питтинговая (точечная) коррозия
- межкристаллитная коррозия
- подповерхностная коррозия
Рисунок 2 – Общая коррозия алюминия: растворение естественной оксидной пленки
растворами сильных щелочей и некоторых кислот [4]
Рисунок 3 – Щелевая коррозия алюминия [4]
Рисунок 4 – Фреттинг-коррозия алюминия: взаимное трение двух алюминиевых компонентов
в условиях шероховатого контакта [4]
Рисунок 5 – Коррозия алюминиевых сплавов под нагрузкой: при определенных условиях
сплавы Al-Cu, Al- Mg, Al-Zn-Mg [4]
Рисунок 6 – Гальваническая коррозия алюминиевого сплава
Происходит в условиях мокрого или мокрого контакта
с другим, более «почетным» металлом, например медью [4]
Рисунок 7 – Питтинговая (питтинговая) коррозия алюминия
под воздействием ионов хлора [4]
Рисунок 8 – Межкристаллитная коррозия и подповерхностная коррозия [4]
В зависимости от условий окружающей среды, нагрузки и функциональности детали любого из видов коррозии могут привести к преждевременному выходу из строя. Более того, неправильная эксплуатация алюминиевых деталей и изделий может усугубить коррозионные процессы.
Более того, неправильная эксплуатация алюминиевых деталей и изделий может усугубить коррозионные процессы.
Гальваническая коррозия алюминия
Наиболее частые ошибки проектирования алюминиевых конструкций связаны с гальванической коррозией. Гальваническая или электрохимическая коррозия возникает, когда два разнородных металла образуют электрическую цепь, замыкаемую жидким электролитом или пленкой, или агрессивной средой. В этих условиях разность потенциалов между разнородными металлами создает электрический ток, проходящий через электролит, который (ток) приводит к коррозии в первую очередь анода или менее благородного металла из этой пары.
РЕЗЮМЕ гальваническая коррозия
Когда два разных металла вступают в непосредственный контакт с электропроводящей жидкостью, опыт показывает, что один из них может подвергаться коррозии, т.е. подвергаться коррозии. Это называется гальванической коррозией.
Другой металл не подвергается коррозии, наоборот, он будет защищен от этого вида коррозии.
Этот вид коррозии отличается от видов коррозии, которые могли бы возникнуть, если бы оба этих металла были помещены по отдельности в одну и ту же жидкость. Гальваническая коррозия может возникнуть с любым металлом, как только два разных металла соприкасаются в электропроводящей жидкости.
Внешний вид гальванической коррозии
Внешний вид гальванической коррозии очень характерен. При этом коррозия не разлетается по всей поверхности изделия, как в случае с точечной — питтинговой — коррозией. Гальваническая коррозия локализуется в зоне плотного контакта алюминия с другим металлом. Коррозионное воздействие на алюминий имеет равномерный характер, оно развивается в глубине кратеров, имеющих более или менее округлую форму [3 [.
Все алюминиевые сплавы одинаково подвержены гальванической коррозии [3].
принцип батареи
Гальваническая коррозия работает как батарея, которая состоит из двух электродов:
- катод, где протекает реакция восстановления
- анод, где протекает реакция окисления.

Эти два электрода погружены в проводящую жидкость, называемую электролитом. Электролит — это обычно разбавленный раствор кислоты, например, серной кислоты, или солевой раствор, например, медный купорос. Эти два электрода подключены к внешней электрической цепи, по которой циркулируют электроны. Внутри жидкости перенос происходит электрическим током, движутся ионы. Жидкость, таким образом, обеспечивает ионное электрическое соединение (рис. 9).).
Рисунок 9 – Принцип действия гальванического элемента [3]
На рисунке 1 показан элемент, в котором электролитом является раствор серной кислоты. Серная кислота полностью диссоциирует в воде (поскольку это сильная кислота) с образованием ионов Н + , определяющих кислотность среды. Происходит следующая электрохимическая реакция [3]:
- цинковый анод окисляется:
Zn → Zn 2+ + 2e −
на медном катоде восстановлены протоны H + :
2n + + 2e − → n 2
Полная реакция:
Zn + H 2 O → Zn (OH) 2 + H 2
Этот элемент производит электричество за счет потребления цинка, который выделяется в виде гидроксида цинка Zn (OH) 2 .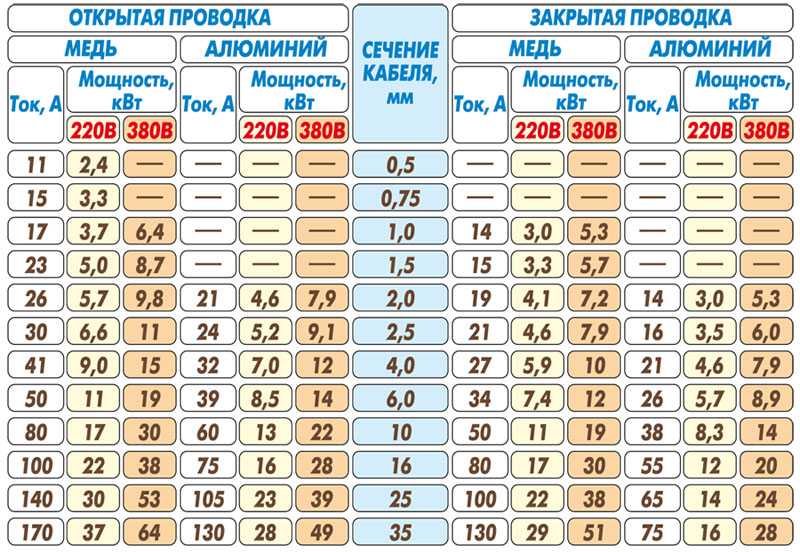
Для работы элемента необходимо одновременное выполнение трех условий:
- два разных металла, образующих два электрода;
- наличие электролита;
- электрическая непрерывность по всей цепи.
Если хотя бы одно из этих условий не выполнено, например, при нарушении электрического контакта, то элемент не будет вырабатывать электричество, и окисления на аноде (как и восстановления на катоде) не произойдет.
Условия гальванической коррозии
Гальваническая коррозия основана на том же принципе, и для ее возникновения необходимо одновременное выполнение следующих трех условий [3]:
- различные виды металлов;
- наличие электролита;
- электрический контакт между двумя металлами.
Различные типы металлов
Для всех металлов, которые относятся к различным типам, возможна гальваническая коррозия. Металл с электроотрицательным потенциалом (или более электроотрицательный металл, если они оба электроотрицательны) действует как анод.
Склонность различных металлов к образованию гальванических паров и направленность электрохимического действия в различных агрессивных средах (морская вода, тропический климат, промышленная атмосфера и др.) показаны в так называемом гальваническом ряду. Чем дальше друг от друга удалены металлы в этих рядах, тем серьезнее может быть гальваническая коррозия. В разных агрессивных средах эти последовательности металлов могут быть разными (рис. 10).
Наличие электролита
Место контакта необходимо смачивать водным раствором, для обеспечения ионной проводимости. В противном случае нет возможности для гальванической коррозии.
Электрический контакт между металлами
Электрический контакт между металлами может осуществляться либо путем непосредственного контакта двух металлов, либо с помощью крепежных деталей, например, болта.
Рисунок 10 [1]
Как видно из рисунка схемы 10 алюминий и его сплавы становятся анодами в электрохимических элементах с большинством металлов, а алюминий корродирует, как говорится, жертвенно защищает от коррозии другие металлы и гальваническую пару.
Только магний и цинк, в том числе из оцинкованной стали, Они более анодны и поэтому, сами подвергаясь коррозии, защищают от нее алюминий.
Алюминий и кадмий вообще имеют почти одинаковые электродные потенциалы и при этом ни алюминий, ни кадмий не подвержены гальванической коррозии. К сожалению, кадмий оказался очень токсичным и используется все реже и реже, а во многих странах просто запрещен в качестве антикоррозионной защиты.
гальванические пары
Взаимное расположение двух металлов или сплавов в гальваническом ряду указывает только на возможность гальванической коррозии, если разность их электрохимических потенциалов достаточно велика. Больше эта цифра ни о чем не говорит, и особенно ничего — о скорости или интенсивности гальванической коррозии. Он может быть нулевым, незначительным или даже невидимым. Интенсивность его зависит от типов металлов, которые вступают в контакт — гальваническая пара.
Пара: алюминий – нелегированная сталь
В строительстве алюминиевые детали, подверженные влиянию климата и погодных условий, могут быть соединены винтами из обычной стали. Опыт показывает, что алюминий при контакте со стальными болтами подвергается лишь очень поверхностной коррозии. Образующаяся ржавчина, не оказывающая никакого влияния на алюминий, полностью пропитывает слой оксида алюминия и образует пятно на поверхности. Собственно, для алюминиевых конструкций при контакте с оголенной сталью важно влияние на ее внешний вид и декоративные качества, а не способность сопротивляться коррозии.
Опыт показывает, что алюминий при контакте со стальными болтами подвергается лишь очень поверхностной коррозии. Образующаяся ржавчина, не оказывающая никакого влияния на алюминий, полностью пропитывает слой оксида алюминия и образует пятно на поверхности. Собственно, для алюминиевых конструкций при контакте с оголенной сталью важно влияние на ее внешний вид и декоративные качества, а не способность сопротивляться коррозии.
Это явление имеет следующее объяснение:
- образуются на контактных поверхностях пленки с продуктами коррозии — ржавчиной на стали и оксидом алюминия на алюминии, которые и замедляют электрохимическую реакцию.
Пара: алюминий – Цинк Сталь
Судя по гальваническому ряду, цинк более электроотрицателен, чем алюминий. Крепеж из оцинкованной стали может, таким образом, применяться для соединения и сборки конструкций из алюминиевых сплавов. Следует помнить, что когда цинковое покрытие слишком изнашивается, чтобы защитить сталь и алюминий, возникает предыдущий сценарий контакта между алюминием и голой сталью [3] .
Пара: алюминий – нержавеющая сталь
Хотя существует большая разность потенциалов между нержавеющей сталью и алюминиевыми сплавами – около 650 мВ, гальваническую коррозию на алюминии в контакте с нержавеющей сталью можно увидеть очень редко. Поэтому алюминиевые конструкции очень часто собирают с помощью болтов и винтов из нержавеющей стали [3].
Пара: алюминий – медь
Контакт между алюминиевыми сплавами и медью, а также медными сплавами (бронза, латунь) приводит к очень незначительной гальванической коррозии алюминия при воздействии атмосферных условий. Тем не менее, рекомендуется обеспечить электрическую изоляцию между двумя металлами, чтобы локализовать коррозию алюминия.
Следует отметить, что продуктом коррозии меди является, т.н., раз a. Эта патина — голубовато-зеленый налет на меди, состоящий в основном из карбоната меди. Эта патина химически воздействует на алюминий и может быть уменьшена до образования мелких частиц меди. Эти частицы меди, в свою очередь, могут вызывать локальную точечную коррозию алюминия [3].
Ближе к прикосновению – больше коррозии
Ускоренная гальваническая коррозия обычно наиболее интенсивна вблизи стыков двух металлов; по мере удаления от стыка его интенсивность уменьшается. Существенное влияние на скорость коррозии оказывает величина отношения площади поверхности катода, контактирующего с электролитом, к площади открытой поверхности анода. Желательно иметь малое отношение площади катода к площади анода.
Как избежать гальванической коррозии
- Подберите для рассматриваемой агрессивной среды пару из алюминия или металлического сплава, максимально приближенную к ней по гальваническому ряду (см. рис. 10).
- Применить крепеж «катод». Избегайте комбинаций с неблагоприятным (большим) соотношением площадей катода и анода (рис. 3).
- Обеспечьте полную электрическую изоляцию двух соединяемых металлов. Этого можно добиться с помощью изолирующих прокладок, втулок, шайб и т. д. (рис. 12).
- Если вы используете краску, вы всегда должны красить катод.
 Если красить только анод, то любая царапина на нем даст неблагоприятное соотношение поверхности катода к поверхности анода, приведет к коррозии и царапинам.
Если красить только анод, то любая царапина на нем даст неблагоприятное соотношение поверхности катода к поверхности анода, приведет к коррозии и царапинам. - Увеличение толщины анода или установка соединения сменной массивной анодной металлической прокладкой.
- По возможности место гальванического контакта находится в агрессивной среде.
- Избегайте резьбовых соединений металла, образующих гальваническую пару. Замените их паяными или сварными соединениями.
- Если возможно, применяйте ингибиторы коррозии, например, системы рециркуляции жидкости, которые могут играть роль в электролитной гальванической коррозии.
- В случаях, когда металлы должны оставаться в электрическом контакте через внешнюю электрическую цепь, необходимо разнести их как можно дальше друг от друга, чтобы увеличить сопротивление жидкостной цепи (электролита).
- При необходимости и там, где это возможно, применяйте катодную защиту с цинковыми или магниевыми расходуемыми анодами.
- В самых агрессивных средах только цинк, кадмий и магний могут контактировать с алюминием без возникновения гальванической коррозии. Отметим, что применение кадмиевых покрытий во многом ограничено из-за их экологической небезопасности.
Рисунок 11 [1]
Рисунок 12 [1]
Источники:
- TALAT 5104.
- Коррозия алюминия и алюминиевых сплавов. Под редакцией Дж. Р. Дэвиса. – АСМ Интернэшнл, 1999.
- Коррозия алюминия / Кристиан Драглайн — ELSEVIER, 2004
- ТАЛАТ 1252
Предотвращение коррозии с помощью гальванического воздействия | Блог архитектора
Статья на SimpleTwig: Гальваническая коррозия, иногда называемая гальваническим действием, описывает коррозию металла, когда этот металл находится в контакте, либо непосредственно, либо с помощью катализатора или другого элемента, с другим металлом, чья характеристики не комплиментарны. Часто два разных металла могут соприкасаться друг с другом без какой-либо коррозии, но некоторые комбинации действительно приводят к коррозии и, в конечном итоге, к выходу из строя. Это может иметь решающее значение для предотвращения «ржавчины» и появления неприглядных пятен, предотвращения проникновения воды при выходе из строя гидроизоляции или даже предотвращения разрушения частей здания при выходе из строя крепежных элементов, таких как винты.
Это может иметь решающее значение для предотвращения «ржавчины» и появления неприглядных пятен, предотвращения проникновения воды при выходе из строя гидроизоляции или даже предотвращения разрушения частей здания при выходе из строя крепежных элементов, таких как винты.
Мы рассмотрим, что это такое и как предотвратить этот тип коррозии, чтобы наши здания служили на многие десятилетия дольше.
Коррозия возникает, когда два металла имеют разные электрические характеристики, а присутствие электролита позволяет сформировать токопроводящий путь между двумя металлами. Этот путь позволяет ионам металла мигрировать от анода (положительно заряженного металла) к катоду (отрицательно заряженному металлу), тем самым ослабляя анод и делая его более восприимчивым к ржавчине. В частности, это связано с электрохимической реакцией, которая происходит, когда два разнородных металла вступают в контакт в присутствии электролита, такого как серная кислота или ацетат натрия.
Вот почему провод имеет защитную изоляционную оболочку, чтобы защитить его ток от перехода на другие металлы. Думайте об этом как о понимании того, что все металлы обладают потенциалом проводимости. Именно разница электродных потенциалов вызывает коррозионное воздействие на положительно заряженный металл (анод), заставляя его растворяться в электролите. Это действие во многом похоже на то, как тепло передается на более холодную сторону стены: люди используют сопротивление изоляции, чтобы замедлить эту передачу, мы отмечаем качество этого сопротивления как R-факторы. Таким образом, даже два «плохих» металла могут быть близки друг к другу, если есть изолятор, препятствующий передаче электричества.
Думайте об этом как о понимании того, что все металлы обладают потенциалом проводимости. Именно разница электродных потенциалов вызывает коррозионное воздействие на положительно заряженный металл (анод), заставляя его растворяться в электролите. Это действие во многом похоже на то, как тепло передается на более холодную сторону стены: люди используют сопротивление изоляции, чтобы замедлить эту передачу, мы отмечаем качество этого сопротивления как R-факторы. Таким образом, даже два «плохих» металла могут быть близки друг к другу, если есть изолятор, препятствующий передаче электричества.
Тем не менее, как уже отмечалось, некоторые разные металлы могут без проблем соприкасаться друг с другом. В строительстве крайне важно знать, какие металлы могут лежать рядом друг с другом, а какие комбинации должны быть либо изолированы, либо размещены достаточно далеко друг от друга, чтобы предотвратить коррозию.
По иронии судьбы, в бетоне, где ацетат натрия, который используется для герметизации бетона и защиты его от атмосферных воздействий, может вызвать гальваническую коррозию металлов, установленных внутри или вокруг него. В этом случае ацетат натрия действует не как резистор (или изоляция), а как катализатор, позволяющий ускорить коррозионное воздействие.
В этом случае ацетат натрия действует не как резистор (или изоляция), а как катализатор, позволяющий ускорить коррозионное воздействие.
Таким образом, важно понимать, что металлы не только не соприкасаются, но и что эти металлы «соприкасаются» или находятся достаточно близко, чтобы между ними проходили ионы через «раствор». Раствор может быть кислотным (как в кислотном дожде), солевым (как в соленой воде) или щелочным раствором, и как таковой по существу воссоздает действие батареи, то есть поток электронов между двумя металлами.
Дождь, Вода, Влажность, Третий Партнер:
Дождь бывает от слегка кислого до очень сильного, особенно в больших городах, где автомобили и грузовики выделяют загрязнения. С другой стороны, кислотный дождь делает то, к чему он прикасается, менее щелочным с точки зрения уровня pH. Поскольку кислотность и щелочность являются двумя сторонами одной медали, их уровни колеблются между ними. С точки зрения гальванического воздействия кислотный или щелочной дождь может увеличить поток электричества между двумя разнородными металлами. В Индии, Австралии и некоторых других частях мира дождь обычно более щелочной.
В Индии, Австралии и некоторых других частях мира дождь обычно более щелочной.
Важно понимать, что именно электролит или, как определено, «жидкость или гель, содержащий ионы и который может быть разложен электролизом», является третьим элементом, необходимым наряду с двумя разнородными металлами для проведения реакции. Поскольку на большинство зданий попадает дождь, это является фактором, способствующим этому. Тем не менее, нельзя сбрасывать со счетов влияние влажности на внутреннюю часть дома или здания, особенно когда для отделки помещения используются металлические стойки, подвесные потолки, металлическая отделка и т. д.
НАИЛУЧШИЕ МЕТОДЫ ПРЕДОТВРАЩЕНИЯ ГАЛЬВАНИЧЕСКОЙ КОРРОЗИИ РАЗНООБРАЗНЫХ МЕТАЛЛОВ:
- Электрическое разделение металлов с помощью непроводящих материалов, которые останавливают миграцию ионов:
- Отдельные металлы с изолятором, подобным пластику;
- Используйте водоотталкивающие составы, такие как смазка, для предотвращения контакта с электролитами;
- Рассмотрите возможность гальванического покрытия благородными металлами* (например, золотом, серебром или платиной), которые лучше противостоят коррозии.

- Применение катодной защиты; Это метод, используемый для контроля коррозии металлической поверхности, превращая ее в катод электрохимической ячейки. Простой метод защиты соединяет защищаемый металл (анод) с более легко подвергающимся коррозии «жертвенным металлом», который действует как анод. Это достигается путем физического соединения анода, который необходимо защитить, проводом с жертвенным металлом.
- Для алюминия и меди нанесите антиоксидантную пасту. Антиоксидантную пасту можно легко найти в Интернете. Иногда ее называют «соединительной смазкой».
ВЫБЕРИТЕ ПОДХОДЯЩИЕ МЕТАЛЛЫ, ЧТОБЫ ИЗБЕЖАТЬ ГАЛЬВАНИЧЕСКОГО ВОЗДЕЙСТВИЯ ВСЕ ВМЕСТЕ:
Просто выбирая металлы, которые избегают гальванического воздействия, никогда не будет проблем. Тем не менее, в современном строительном мире подрядчик может легко смешать неправильный тип крепежа с неправильным металлом.
В этом отношении нужно понять, как читать следующую таблицу, в которой перечислены все металлы. Затем SimpleTwig попытается извлечь наиболее часто используемые конструкционные металлы для отдельной таблицы, чтобы обеспечить предотвращение гальванического действия в наших проектах и для тех, кто использует эту статью в своих проектах.
Затем SimpleTwig попытается извлечь наиболее часто используемые конструкционные металлы для отдельной таблицы, чтобы обеспечить предотвращение гальванического действия в наших проектах и для тех, кто использует эту статью в своих проектах.
Глядя на медь, часто используемую в металлических отливах, желобах и водосточных трубах, диаграмма показывает, что нет никаких проблем при контакте с алюминием (но см. примечания по меди ниже), сталью или чугуном, но есть представляет собой проблему при контакте с нержавеющей сталью, другим распространенным металлом с блестящим покрытием.
Чтобы понять эту диаграмму, «более благородными» металлами являются анодные металлы в нижней части диаграммы, то есть, хотя золото является благородным металлом, бронза более благородна, чем чугун. Наименее благородным металлом является магний и его сплавы.
В другой форме в виде списка мы показываем наиболее анодные (подверженные коррозии металлы) вплоть до наиболее катодных металлов (пассивных в том смысле, что они не подвергаются коррозии, но пропускают ионы при контакте с «плохим» металлом). ).
).
АНОДНЫЙ – активный
- Магниевые сплавы
- Цинк
- Бериллий
- Алюминий 1100, 3003, 3004, 5052, 6053
- Оцинкованная сталь
- Кадмий
- Алюминий 2017, 2024, 2117
- Мягкая сталь (1018), Кованое железо
- Чугун, Низколегированная высокопрочная сталь
- Хромированное железо (активное)
- Нержавеющая сталь, серия 430 (активная)
- Нержавеющая сталь 302, 303, 304, 321, 347, 410, 416, (активная)
- Никель (резистивный)
- Нержавеющая сталь 316, 317, (активная)
- Плотник 20 CB-3 нержавеющий (активный)
- Алюминий Бронза (CA 687)
- Hastelloy C (активный), Inconel 625 (активный), титан (активный)
- Припои свинцово-оловянные
- Свинец
- Олово
- Инконель 600 (активный)
- Никель (активный)
- Латунь (морская, желтая, красная, адмиралтейская)
- Медь (CA102)
- Марганцевая бронза, оловянная бронза
- Кремниевая бронза
- Нейзильбер
- Медно-никелевый сплав
- 430 нержавеющая сталь
- Никель (пассивный), алюминий, бронза
- Монель 400, К500
- Серебряный припой
- Никель (пассивный)
- Хромированное железо (пассивное)
- 302, 303, 304, 321, 347, нержавеющая сталь (пассивная)
- 316, 317, нержавеющая сталь (пассивная)
- Carpenter 20 CB-3 нержавеющая сталь (пассивная), Incoloy 825
- Сплав никель-молибде-хром-железо (пассивный)
- Серебро
- Титан и титановые сплавы
- Графит
- Цирконий
- Золото
- Платина
Катодный – пассивный
ПРИМЕНЕНИЕ НЕКОТОРЫХ МЕТАЛЛОВ В СТРОИТЕЛЬСТВЕ:
Кадмий:
Cad мий часто является жертвенным металлом, используемым в качестве покрытия на других металлах для предотвращения коррозии основного металла. Кадмий с гальваническим покрытием представляет собой прочное и универсальное металлическое покрытие, мягкий белый металл, который при нанесении на сталь, чугун, ковкий чугун, медь и порошковый металл действует как защитный слой для материала подложки. Чтобы усилить защиту от коррозии при использовании кадмирования, на металл с покрытием можно нанести хроматные конверсионные покрытия, придающие знакомый золотой или оливково-серый цвет.
Кадмий с гальваническим покрытием представляет собой прочное и универсальное металлическое покрытие, мягкий белый металл, который при нанесении на сталь, чугун, ковкий чугун, медь и порошковый металл действует как защитный слой для материала подложки. Чтобы усилить защиту от коррозии при использовании кадмирования, на металл с покрытием можно нанести хроматные конверсионные покрытия, придающие знакомый золотой или оливково-серый цвет.
Это покрытие хорошо сочетается с адгезионными клеями (авиационная промышленность) и в условиях соленой воды. Дополнительную информацию можно найти здесь: http://www.chemprocessing.com/page.asp?pageid=54&
Медь:
шины.
Алюминий очень подвержен гальванической коррозии при контакте с медью, с электролитом, таким как вода, с некоторым содержанием ионов. Например, медные болты можно оловить, чтобы остановить или замедлить гальваническую атаку. Эта коррозия может быть критической в самолете, но может быть поверхностной в архитектурных проектах, поскольку алюминий будет подвергаться коррозии, но, например, дождевая вода не обладает высокой проводимостью, учитывая, что в сильно загрязненных городах это может быть изменяющимся фактором.
Крепеж:
Поскольку болты, винты и сварные швы окружены материалами, которые они скрепляют, они могут играть роль анода, что может привести к быстрой коррозии, поэтому их следует избегать. Крепежи с цинковым покрытием используются только со сталью, покрытой алюминием, цинком и алюминием. Крепеж с цинковым или алюминиевым покрытием не должен прикреплять панели из меди или нержавеющей стали.
Чтобы свести к минимуму риск, совместите металл поверхности как на застежке, так и на металле, к которому он присоединяется. При необходимости подберите «большой анод» (металл, который будет ржаветь) с небольшим катодом, чтобы ограничить коррозию, т. е. используйте крепежные детали, такие как болты и винты, из металла с меньшей вероятностью коррозии или более катодного, чем металл, к которому он крепится. 9Таблица совместимости 0003 от SimpleTwig Architecture.
Сведение к минимуму гальванической коррозии:
- использовать аналогичные металлы;
- предотвращают намокание разнородных металлов, электрическое соединение водой или влажностью;
- предотвращают соприкосновение «маленьких анодов» с «большими катодами»;
- добавляют защитные покрытия, известные как расходуемые покрытия, для защиты основного металла и его функций;
- добавить другие покрытия, такие как краска, пластик или другой неметаллический барьер.
 Обратите внимание, что лакокрасочное покрытие может быть поцарапано и, таким образом, обнажится металл, а изделие подвержено гальваническому воздействию при контакте с другим металлом.
Обратите внимание, что лакокрасочное покрытие может быть поцарапано и, таким образом, обнажится металл, а изделие подвержено гальваническому воздействию при контакте с другим металлом.
Консерванты для древесины (палубы): , содержащие медь, ртуть или фториды.
Не допускайте прямого контакта панелей и отделки из алюминия, алюминиевого и гальванического покрытия с консервантами для древесины, содержащими медь, ртуть или фториды. Избегайте прямого контакта между голыми металлическими панелями и обработанной древесиной, когда на металлической поверхности, соприкасающейся с древесиной, часто образуется конденсат, а обработка древесины «более благородна», чем металлическая поверхность. Используйте соответствующий барьер, чтобы разделить их.
Пассивирование:
Процесс, заключающийся в очистке и герметизации поверхности, снижает электрический потенциал металла и улучшает его коррозионные свойства.
Пример:
Соединение латунной пластины с алюминиевой пластиной с помощью болта из нержавеющей стали 304. И латунь, и алюминий будут сильно коррозировать там, где они соприкасаются с нержавеющей сталью, потому что они гораздо более анодированы, чем нержавеющая сталь. Алюминий будет подвергаться коррозии больше, потому что он более анодный, чем латунь, а также будет подвергаться коррозии в местах контакта с латунью, поскольку латунь более катодная.
И латунь, и алюминий будут сильно коррозировать там, где они соприкасаются с нержавеющей сталью, потому что они гораздо более анодированы, чем нержавеющая сталь. Алюминий будет подвергаться коррозии больше, потому что он более анодный, чем латунь, а также будет подвергаться коррозии в местах контакта с латунью, поскольку латунь более катодная.
В этом случае между латунью и алюминием должен быть барьер с выбором болта, совместимого с обоими материалами.
ЗАКЛЮЧЕНИЕ :
Для крупных проектов крайне важно, чтобы для проекта был назначен профессиональный составитель спецификаций, который полностью понимает, какие материалы используются/предлагаются, и может дать рекомендации по изменениям или определить подходящие покрытия. , разделения и изоляторы для предотвращения гальванического воздействия.
В небольших жилых проектах часто уверенность в надлежащем использовании материалов ложится на Подрядчика, а иногда Архитектор участвует в обоих плечах для предотвращения коррозии металла. В любом случае следует обратить внимание на основные материалы дома, включая деревянный настил (и винты из нержавеющей стали или болты с покрытием), медные желоба и водосточные трубы (с использованием медных крепежных элементов), алюминиевые пороги, кровельные крепежные элементы и т. д., чтобы убедиться, что эти компоненты прочно держатся. со временем и функционируют, как задумано структурно. Таким образом, можно предотвратить появление пятен, неприглядных изъянов или окисления, а также разрушение конструкции.
В любом случае следует обратить внимание на основные материалы дома, включая деревянный настил (и винты из нержавеющей стали или болты с покрытием), медные желоба и водосточные трубы (с использованием медных крепежных элементов), алюминиевые пороги, кровельные крепежные элементы и т. д., чтобы убедиться, что эти компоненты прочно держатся. со временем и функционируют, как задумано структурно. Таким образом, можно предотвратить появление пятен, неприглядных изъянов или окисления, а также разрушение конструкции.
Не забудьте прочитать больше наших практических статей и статей о технологиях в нашем блоге SimpleTwig Architect. Или просто выберите новую категорию из списка в правой колонке. Комментарии приветствуются и приветствуются.
СНОСКИ:
*Благородные металлы включают: рутений, родий, палладий, серебро, осмий, иридий, платину, золото. Эти металлы могут действовать как изолятор, предотвращая гальваническое воздействие и тем самым предотвращая коррозию.