Ароматические соединения
Ароматические соединения (арены) — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения.
Различают бензоидные (арены и структурные производные аренов, содержат бензольные ядра) и небензоидные (все остальные) ароматические соединения. Среди небензоидных ароматических соединений хорошо известны азулен, аннулены, гетарены (пиридин, пиррол, фуран, тиофен), ферроцен. Известны и неорганические ароматические соединения, например боразол («неорганический бензол»).
В структуре молекул многих соединений можно выделить несколько ароматических систем, которые могут быть по отношению друг к другу изолированными либо конденсированными. В качестве примеров бензоидных соединений с изолированными бензольными ядрами можно назвать такие соединения как дифенилметан и полистирол, с удалёнными друг от друга бензольными ядрами, а также дифенил и терфенилы с непосредственно связанными ядрами. Примерами бензоидных соединений с конденсированными (аннелированными) бензольными ядрами являются такие соединения как нафталин, пирен и прочие ПАУ. В структуре дифенилена бензольные ядра непосредственно связаны друг с другом, но, в отличие от дифенила, у дифенилена бензольные ядра не являются изолированными. Если принять во внимание тот факт, что в одной молекуле может различным образом сочетаться различное число различных ароматических и неароматических групп, то становится очевидно, что число возможных ароматических соединений и их разнообразие практически не ограничены.
Примерами бензоидных соединений с конденсированными (аннелированными) бензольными ядрами являются такие соединения как нафталин, пирен и прочие ПАУ. В структуре дифенилена бензольные ядра непосредственно связаны друг с другом, но, в отличие от дифенила, у дифенилена бензольные ядра не являются изолированными. Если принять во внимание тот факт, что в одной молекуле может различным образом сочетаться различное число различных ароматических и неароматических групп, то становится очевидно, что число возможных ароматических соединений и их разнообразие практически не ограничены.
Широко распространены и имеют большое практическое значение бензоидные ароматические углеводороды (арены). Помимо бензольных колец арены часто содержат другие разнообразные углеводородные группы (алифатические, нафтеновые, полициклические). Основным источником получения ароматических углеводородов служат каменноугольная смола, нефть и нефтепродукты. Большое значение имеют синтетические методы получения. Наиболее важными аренами являются: бензол С6Н6 и его гомологи (толуол С6Н5СНз, ксилолы С6Н4(СНз)2, дурол, мезитилен, этилбензол), кумол, нафталин C10H8, антрацен С14Н10 и их производные. Ароматические углеводороды — исходное сырьё для промышленного получения кетонов, альдегидов и кислот ароматического ряда, а также многих других веществ.
Ароматические углеводороды — исходное сырьё для промышленного получения кетонов, альдегидов и кислот ароматического ряда, а также многих других веществ.
Этилбензольная фракция (ЭБФ)
Цена по запросу
Подробнее
Фракция ароматических углеводородов (ФАУ)
Цена по запросу
Подробнее
Толуол нефтяной
Цена по запросу
Подробнее
Альфа-метилстирол (АМС)
Цена по запросу
Растворитель ароматический АР
Цена по запросу
Ароматические углеводороды — Что такое Ароматические углеводороды?
286138
Ароматические углеводороды (арены) – это углеводороды, молекулы которых содержат одно или несколько бензольных колец.
Ароматические углеводороды (арены) — класс углеводородов, содержащих бензольные ядра, которые могут быть конденсированными и иметь насыщенные боковые цепи.
К наиболее важным аренам относятся бензол (С6Н6) и его гомологи.
Это углеводороды, молекулы которых содержат 1 или несколько бензольных колец, и другие углеводородные группы (алифатические, нафтеновые, полициклические).
Простейшим представителем ароматических углеводородов является бензол, молекулярная формула которого С
Установлено, что все атомы углерода в молекуле бензола лежат в одной плоскости, образуя правильный 6-угольник .
Каждый атом углерода связан с одним атомом водорода.
Длины всех связей углерод-углерод одинаковы и составляют 0,139 нм.
Для передачи строение молекулы бензола используют формулы Кекуле, которые предложил в 1865 г. немецкий химик Август Кекуле.
Важными аренами являются и гомологи бензола (толуол С6Н5СНз, ксилолы С6Н4(СНз)2, дурол, мезитилен, этилбензол), кумол, нафталин C10H8, антрацен С14Н10 и их производные.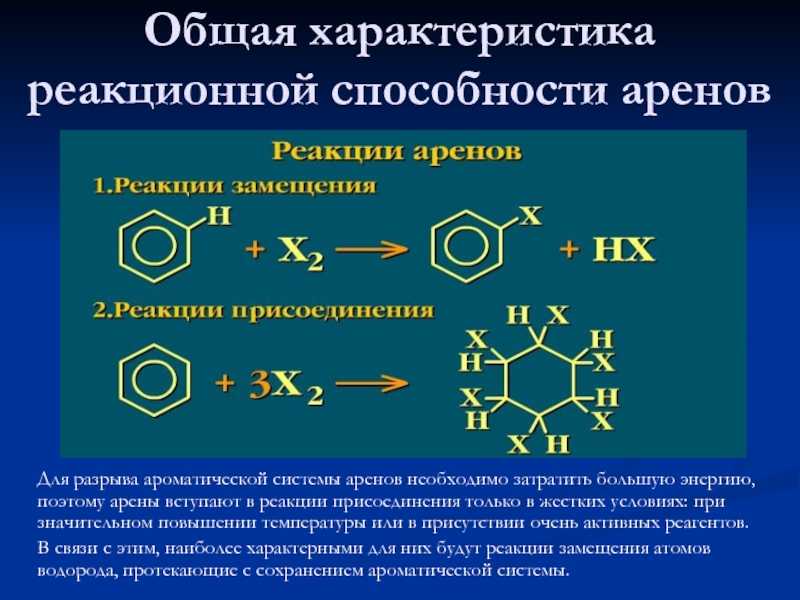
Ароматические углеводороды — исходное сырье для промышленного получения кетонов, альдегидов и кислот ароматического ряда, и других веществ.
Исторически название «ароматические углеводороды» сложилось потому, что многие производные бензола, которые первыми были выделены из природных источников, обладали приятным запахом.
В настоящее время под понятием «ароматичность» подразумевают, прежде всего, особый характер реакционной способности веществ, обусловленный, в свою очередь, особенностями строения молекул этих соединений.
В чем же состоят эти особенности?
В соответствии с молекулярной формулой С6Н6 бензол является ненасыщенным соединением, и можно ожидать, что для него были бы характерны типичные для алкенов реакции присоединения.
Однако в условиях, в которых алкены быстро вступают в реакции присоединения, бензол не реагирует или реагирует медленно.
Бензол не дает и характерных качественных реакций, свойственных непредельным углеводородам: он не обесцвечивает бромную воду и водный раствор перманганата калия.
Такой характер реакционной способности объясняется наличием в ароматическом кольце сопряженной системы — единого «пи»-электронного облака.
#Ароматические #углеводороды #арены #молекулы #бензольное #кольцо
Последние новости
Ароматические системы и факторы, необходимые для ароматичности
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1198
- William Reusch
- Университет штата Мичиган
Многие ненасыщенные циклические соединения обладают исключительными свойствами, которые мы теперь считаем характерными для «ароматических» систем. Показательны следующие случаи:
Показательны следующие случаи:
| Соединение | Структурный Формула | Реакция с Br 2 | Термодинамический Стабилизация |
|---|---|---|---|
| 1,3-циклопентадиен | Добавление ( 0 ºC ) | Легкий | |
| 1,3,5-Циклогептатриен | Добавление (0 ºC) | Легкий | |
| 1,3,5,7-циклооктатетраен | Добавление (0 ºC) | Легкий | |
| Бензол | Замена | Большой | |
| Пиридин | Замена | Большой | |
| Фуран | Замена (0 ºC) | Умеренный | |
| Пиррол | Замена | Умеренный |
Первые три соединения (циклические полиены) в целом обладают свойствами, связанными с алкенами.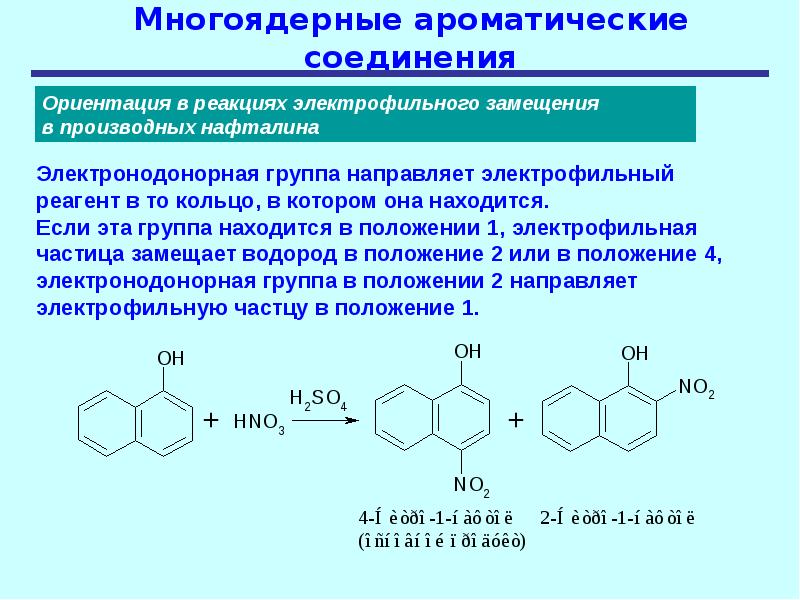 Каждый из них легко реагирует с бромом с образованием продуктов присоединения, как и большинство алкенов. Термодинамическое изменение при введении двойных связей в кольцо атома углерода также типично для алкенов (дестабилизация около 26 ккал/моль на каждую двойную связь). Конъюгация компенсирует это увеличение энергии на небольшое количество (4-6 ккал/моль).
Каждый из них легко реагирует с бромом с образованием продуктов присоединения, как и большинство алкенов. Термодинамическое изменение при введении двойных связей в кольцо атома углерода также типично для алкенов (дестабилизация около 26 ккал/моль на каждую двойную связь). Конъюгация компенсирует это увеличение энергии на небольшое количество (4-6 ккал/моль).
Остальные четыре соединения обладают очень разными свойствами и считаются ароматическими. Бензол и пиридин относительно не вступают в реакцию с бромом, для ускорения реакции требуется тепло и/или катализаторы, результатом которых является замещение, а не присоединение. Фуран и пиррол быстрее реагируют с бромом, но также дают продукты замещения. Эта тенденция отдавать предпочтение замещению, а не добавлению, предполагает, что исходная ненасыщенная кольцевая система обладает исключительной стабильностью. Термодинамические измерения подтверждают этот вывод. Повышенная стабильность, часто называемая 
Факторы, необходимые для ароматичности
- Плоский (или почти плоский) цикл sp 2 гибридизованных атомов, р-орбитали которых ориентированы параллельно друг другу. Эти перекрывающиеся p-орбитали образуют массив π-молекулярных орбиталей.
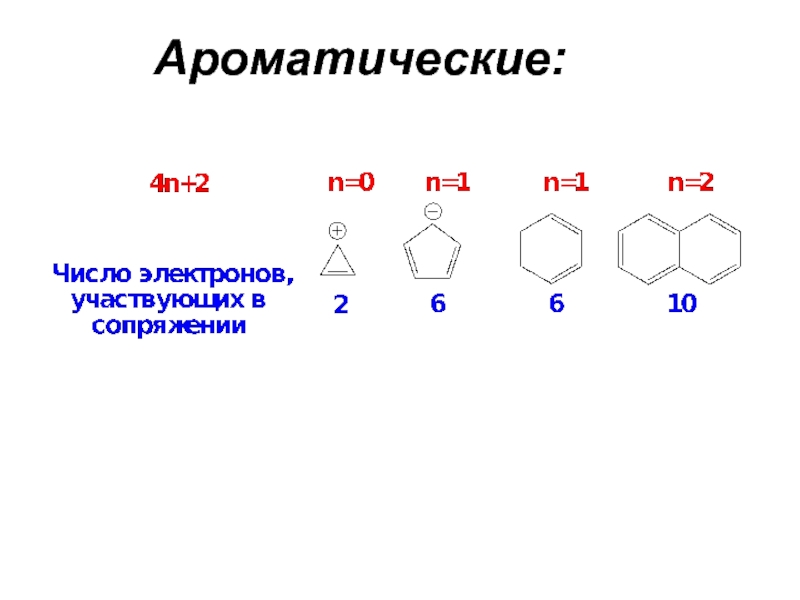
- Эти π-орбитали заняты 4n+2 электронами (где n — целое число или ноль). Это требование известно как Правило Хюккеля . Все рассмотренные выше ароматические соединения имеют 6 π-электронов (n=1).
1,3-Циклопентадиен и 1,3,5-циклогептатриен не удовлетворяют первому требованию, поскольку один атом углерода каждого кольца находится в состоянии sp 3 гибридизации и не имеет р-орбитали. Циклооктатетраен не удовлетворяет обоим требованиям, хотя и имеет кольцо из sp 2 гибридизованных атомов. Эта молекула не плоская (геометрия, которая имеет валентные углы 135º). Угловая деформация снимается за счет принятия конформации в форме ванны; следовательно, p-орбитали могут перекрываться только изолированными парами, а не по всему кольцу. Кроме того, циклооктатетраен имеет 8 π-электронов, что не соответствует правилу Хюккеля.
Кроме того, циклооктатетраен имеет 8 π-электронов, что не соответствует правилу Хюккеля.
Бензол является типичным ароматическим соединением. Он плоский, валентные углы = 120º, все атомы углерода в кольце sp
Выше показаны четыре показательных примера ароматических соединений.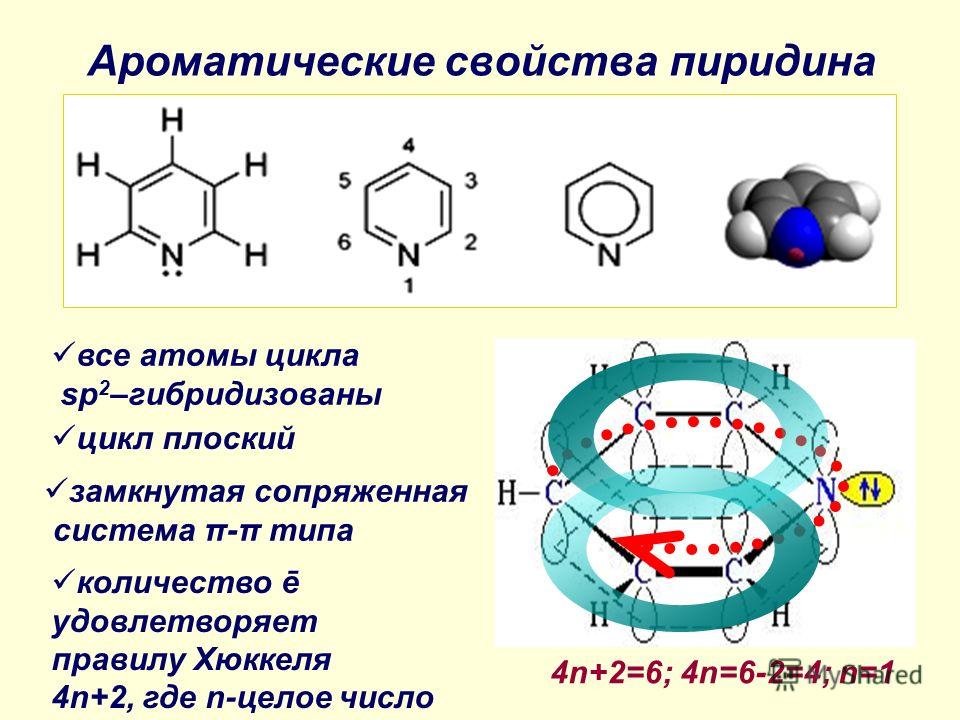 Атомы гибридизованного кольца sp 2 соединены коричневыми связями, π-электронные пары и связи, составляющие ароматическое кольцо, окрашены в синий цвет. Электронные пары, не входящие в состав ароматической π-электронной системы, окрашены в черный цвет. Первым примером является азулен, ароматический углеводород с 10 π-электронами синего цвета, изомерный с нафталином. Второе и третье соединения представляют собой гетероциклы, обладающие ароматическими свойствами. Пиридин имеет бензольное шестичленное кольцо, включающее один атом азота. Несвязывающая электронная пара азота не является частью ароматического секстета π-электронов и может связываться с протоном или другим электрофилом, не разрушая ароматическую систему. В случае тиофена, сернистого аналога фурана, одна из электронных пар серы (окрашена синим цветом) участвует в π-электронном сопряжении ароматического кольца. Последнее соединение представляет собой имидазол, гетероцикл с двумя атомами азота. Обратите внимание, что только одна из несвязывающих электронных пар азота используется для секстета ароматических π-электронов.
Атомы гибридизованного кольца sp 2 соединены коричневыми связями, π-электронные пары и связи, составляющие ароматическое кольцо, окрашены в синий цвет. Электронные пары, не входящие в состав ароматической π-электронной системы, окрашены в черный цвет. Первым примером является азулен, ароматический углеводород с 10 π-электронами синего цвета, изомерный с нафталином. Второе и третье соединения представляют собой гетероциклы, обладающие ароматическими свойствами. Пиридин имеет бензольное шестичленное кольцо, включающее один атом азота. Несвязывающая электронная пара азота не является частью ароматического секстета π-электронов и может связываться с протоном или другим электрофилом, не разрушая ароматическую систему. В случае тиофена, сернистого аналога фурана, одна из электронных пар серы (окрашена синим цветом) участвует в π-электронном сопряжении ароматического кольца. Последнее соединение представляет собой имидазол, гетероцикл с двумя атомами азота. Обратите внимание, что только одна из несвязывающих электронных пар азота используется для секстета ароматических π-электронов.
Аннулены
Моноциклические соединения, состоящие из чередующихся сопряженных двойных связей, называются аннуленами . Примерами аннуленов являются бензол и 1,3,5,7-циклооктатетраен; они называются [6]аннулен и [8]аннулен соответственно в соответствии с общей номенклатурной системой, в которой число пи-электронов в аннулене обозначается числом в скобках. Некоторые аннулены являются ароматическими (например, бензол), но многие из них не из-за непланарности или несоблюдения правила Хюккеля. Соединения, классифицируемые как [10]аннулены (система правил Хюккеля), служат иллюстрацией этих факторов.
Как показано на следующей диаграмме, 1,3,5,7,9-циклодекапентаен не может принять плоскую конформацию ни во всей цис-конфигурации, ни в своей 1,5-транс-изомерной форме. Трансаннулярное скопление водорода, дестабилизирующее последний, можно устранить, заменив внутренние атомы водорода связью или коротким мостиком (на диаграмме окрашены в пурпурный цвет).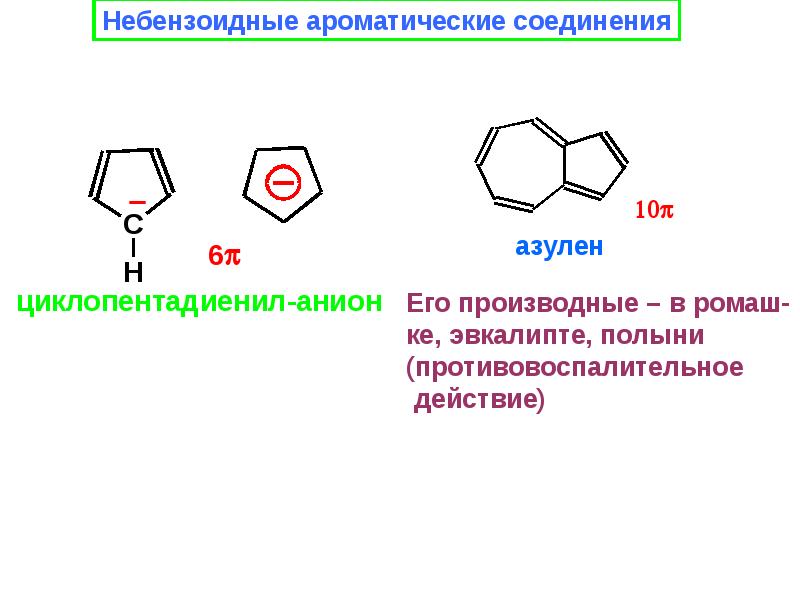 Как и ожидалось, полученные производные аннулена с 10 π-электронами проявляют ароматическую стабильность и реакционную способность, а также характерную анизотропию кольцевого тока в ЯМР. Нафталин и азулен являются аналогами [10]аннулена, стабилизированными трансаннулярной связью. Хотя СН 2 мостиковая структура справа от нафталина на диаграмме не совсем плоская, сопряженное 10 π-электронное кольцо достаточно близко к плоскостности для достижения ароматической стабилизации. Мостиковое соединение [14]аннулена в крайнем правом углу также обладает ароматическими свойствами.
Как и ожидалось, полученные производные аннулена с 10 π-электронами проявляют ароматическую стабильность и реакционную способность, а также характерную анизотропию кольцевого тока в ЯМР. Нафталин и азулен являются аналогами [10]аннулена, стабилизированными трансаннулярной связью. Хотя СН 2 мостиковая структура справа от нафталина на диаграмме не совсем плоская, сопряженное 10 π-электронное кольцо достаточно близко к плоскостности для достижения ароматической стабилизации. Мостиковое соединение [14]аннулена в крайнем правом углу также обладает ароматическими свойствами.
Недавно химиками Калифорнийского технологического института был получен модифицированный [10]аннулен, ароматический по критериям ЯМР. Примечательно, что этот углеводород химически нестабилен, в отличие от большинства других ароматических углеводородов.
Баррелен
Формулировка правила Хюккеля побудила химиков-органиков рассмотреть возможную ароматичность многих необычных ненасыщенных углеводородов. Одним из таких соединений была бициклическая структура с 6 π-электронами, теперь известная как баррелен. Хотя π-связи в баррелене не компланарны, считалось, что трансаннулярное перекрытие все же может приводить к ароматической стабилизации.
Одним из таких соединений была бициклическая структура с 6 π-электронами, теперь известная как баррелен. Хотя π-связи в баррелене не компланарны, считалось, что трансаннулярное перекрытие все же может приводить к ароматической стабилизации.
Синтез баррелена (бицикло[2.2.2]-2,5,7-октатриена) был осуществлен почти пятьдесят лет назад Х. Циммерманом (Висконсин) с использованием двойного элиминирования Хофмана. Как показано на следующей диаграмме, химическое поведение этого триена подтверждает, что он не является ароматическим в общепринятом смысле этого термина. Присоединение брома происходит быстро с образованием трансаннулярной связи, так же, как и с норборнадиеном (бицикло[2.2.1]-2,5-гептадиен). Пиролиз баррелена дал ожидаемые продукты циклореверсии бензол и ацетилен.
Теплота гидрирования баррелена отражает его термодинамическую стабильность. Значение для циклогексена составляет -28 ккал/моль, что значительно меньше одной трети барреленового числа. Кроме того, первая двойная связь баррелена восстанавливается с выделением 36,7 ккал/моль тепла, что указывает скорее на дестабилизацию, чем на стабилизацию. Электронный спектр баррелена показывает взаимодействие π-электронов, аналогичное взаимодействию родственных гомосопряженных диенов. (λ max ≅220-230 нм).
Кроме того, первая двойная связь баррелена восстанавливается с выделением 36,7 ккал/моль тепла, что указывает скорее на дестабилизацию, чем на стабилизацию. Электронный спектр баррелена показывает взаимодействие π-электронов, аналогичное взаимодействию родственных гомосопряженных диенов. (λ max ≅220-230 нм).
Объяснение отсутствия ароматического поведения в случае баррелена можно найти, сравнив орбитальную симметрию шестикомпонентных р-орбиталей с симметрией бензола. Бензол представляет собой кольцо, в котором все шесть p-орбиталей могут быть ориентированы с конгруэнтными перекрывающимися фазами. Цилиндрический массив p-орбиталей в баррелене не может быть устроен так, как показано на диаграмме справа. Всегда будет одна область (узловая плоскость), в которой трансаннулярное перекрытие неконгруэнтно. При нажатии на эту диаграмму в отдельном окне отобразится модель баррелена Jmol. Эту модель можно перемещать для просмотра. Также могут отображаться p-орбитали двойных связей.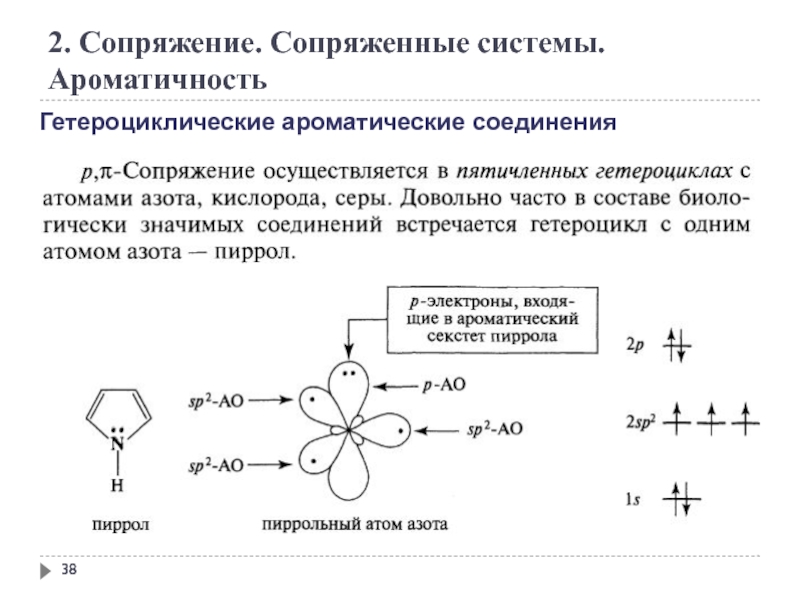
Авторы
- Уильям Реуш, почетный профессор (штат Мичиган, Университет штата Мичиган), Виртуальный учебник органической химии
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Уильям Ройш
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
Другие ароматические системы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 6148
- Уильям Ройш
- Университет штата Мичиган
Введение
Многие ненасыщенные циклические соединения обладают исключительными свойствами, которые мы сейчас считаем характерными для «ароматических» систем. Показательны следующие корпуса:
Соединение | Структурный | Реакция | Термодинамический |
|---|---|---|---|
1,3-циклопентадиен | Добавление (0 ºC) | Легкий | |
1,3,5-Циклогептатриен | Добавление (0 ºC) | Легкий | |
1,3,5,7-циклооктатетраен | Добавление (0 ºC) | Легкий | |
Бензол | Замена | Большой | |
Пиридин | Замена | Большой | |
Фуран | Замена (0 ºC) | Умеренный | |
Пиррол | Замена | Умеренный |
Первые три соединения (циклические полиены) в целом обладают свойствами, связанными с алкенами. Каждый из них легко реагирует с бромом с образованием продуктов присоединения, как и большинство алкенов. Термодинамическое изменение при введении двойных связей в кольцо атома углерода также типично для алкенов (дестабилизация около 26 ккал/моль на каждую двойную связь). Конъюгация компенсирует это увеличение энергии на небольшое количество (4-6 ккал/моль).
Каждый из них легко реагирует с бромом с образованием продуктов присоединения, как и большинство алкенов. Термодинамическое изменение при введении двойных связей в кольцо атома углерода также типично для алкенов (дестабилизация около 26 ккал/моль на каждую двойную связь). Конъюгация компенсирует это увеличение энергии на небольшое количество (4-6 ккал/моль).
Остальные четыре соединения обладают очень разными свойствами и считаются ароматическими. Бензол и пиридин относительно не вступают в реакцию с бромом, для ускорения реакции требуется тепло и/или катализаторы, результатом которых является замещение, а не присоединение. Фуран и пиррол быстрее реагируют с бромом, но также дают продукты замещения. Эта тенденция отдавать предпочтение замещению, а не добавлению, предполагает, что исходная ненасыщенная кольцевая система обладает исключительной стабильностью. Термодинамические измерения подтверждают этот вывод. Повышенная стабильность, часто называемая ароматической стабилизацией, находится в диапазоне (в приведенных выше случаях) от 16 ккал/моль для фурана до 36 ккал/моль для бензола.
Факторы, необходимые для ароматичности
Плоский (или почти плоский) цикл sp 2 гибридизованных атомов, p-орбитали которых ориентированы параллельно друг другу. Эти перекрывающиеся p-орбитали образуют массив π-молекулярных орбиталей.
Эти π-орбитали заняты 4n+2 электронами (где n — целое число или ноль). Это требование известно как правило Хюккеля. Все рассмотренные выше ароматические соединения имеют 6 π-электронов (n=1).
1,3-Циклопентадиен и 1,3,5-циклогептатриен не удовлетворяют первому требованию, поскольку один атом углерода в каждом кольце имеет sp 3 гибридизован и не имеет р-орбитали. Циклооктатетраен не удовлетворяет обоим требованиям, хотя и имеет кольцо из sp 2 гибридизованных атомов. Эта молекула не плоская (геометрия, которая имеет валентные углы 135º). Угловая деформация снимается за счет принятия конформации в форме ванны; следовательно, p-орбитали могут перекрываться только изолированными парами, а не по всему кольцу. Кроме того, циклооктатетраен имеет 8 π-электронов, что не соответствует правилу Хюккеля.
Кроме того, циклооктатетраен имеет 8 π-электронов, что не соответствует правилу Хюккеля.
Бензол является типичным ароматическим соединением. Оно плоское, валентные углы = 120º, все атомы углерода в кольце имеют sp 2 гибридизуются, а пи-орбитали заняты 6 электронами. Ароматический гетероцикл пиридин похож на бензол и часто используется в качестве слабого основания для удаления протонов. Фуран и пиррол имеют гетероциклические пятичленные кольца, в которых гетероатом имеет по крайней мере одну пару несвязывающих электронов валентной оболочки. Путем гибридизации этого гетероатома с состоянием sp2 создается p-орбиталь, занятая парой электронов и ориентированная параллельно p-орбиталям углерода. Полученное плоское кольцо удовлетворяет первому требованию ароматичности, а π-система занята 6 электронами, 4 от двух двойных связей и 2 от гетероатома, что удовлетворяет правилу Хюккеля.
Выше показаны четыре иллюстративных примера ароматических соединений. Атомы sp2-гибридного кольца соединены коричневыми связями, π-электронные пары и связи, составляющие ароматическое кольцо, окрашены в синий цвет. Электронные пары, не входящие в состав ароматической π-электронной системы, окрашены в черный цвет. Первым примером является азулен, ароматический углеводород с 10 π-электронами синего цвета, изомерный с нафталином. Второе и третье соединения представляют собой гетероциклы, обладающие ароматическими свойствами. Пиридин имеет бензольное шестичленное кольцо, включающее один атом азота. Несвязывающая электронная пара азота не является частью ароматического секстета π-электронов и может связываться с протоном или другим электрофилом, не разрушая ароматическую систему. В случае тиофена, сернистого аналога фурана, одна из электронных пар серы (окрашена синим цветом) участвует в π-электронном сопряжении ароматического кольца. Последнее соединение представляет собой имидазол, гетероцикл с двумя атомами азота. Обратите внимание, что только одна из несвязывающих электронных пар азота используется для секстета ароматических π-электронов. Другая электронная пара (закрашенная черным цветом) ведет себя аналогично электронной паре в пиридине.
Электронные пары, не входящие в состав ароматической π-электронной системы, окрашены в черный цвет. Первым примером является азулен, ароматический углеводород с 10 π-электронами синего цвета, изомерный с нафталином. Второе и третье соединения представляют собой гетероциклы, обладающие ароматическими свойствами. Пиридин имеет бензольное шестичленное кольцо, включающее один атом азота. Несвязывающая электронная пара азота не является частью ароматического секстета π-электронов и может связываться с протоном или другим электрофилом, не разрушая ароматическую систему. В случае тиофена, сернистого аналога фурана, одна из электронных пар серы (окрашена синим цветом) участвует в π-электронном сопряжении ароматического кольца. Последнее соединение представляет собой имидазол, гетероцикл с двумя атомами азота. Обратите внимание, что только одна из несвязывающих электронных пар азота используется для секстета ароматических π-электронов. Другая электронная пара (закрашенная черным цветом) ведет себя аналогично электронной паре в пиридине.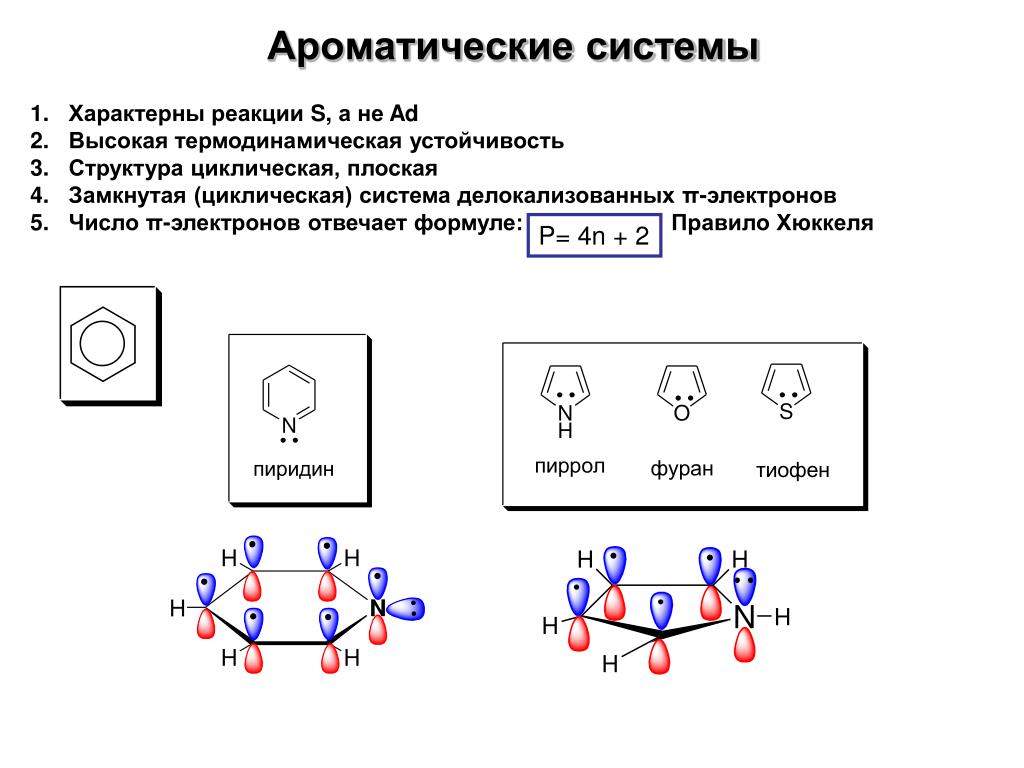
Аннулены
Моноциклические соединения, состоящие из чередующихся сопряженных двойных связей, называются аннуленами. Примерами аннуленов являются бензол и 1,3,5,7-циклооктатетраен; они называются [6]аннулен и [8]аннулен соответственно в соответствии с общей номенклатурной системой, в которой число пи-электронов в аннулене обозначается числом в скобках. Некоторые аннулены являются ароматическими (например, бензол), но многие из них не из-за непланарности или несоблюдения правила Хюккеля. Соединения, классифицируемые как [10]аннулены (система правил Хюккеля), служат иллюстрацией этих факторов.
Как показано на следующей диаграмме, 1,3,5,7,9-циклодекапентаен не может принять плоскую конформацию ни во всей цис-конфигурации, ни в своей 1,5-транс-изомерной форме. Трансаннулярное скопление водорода, дестабилизирующее последний, можно устранить, заменив внутренние атомы водорода связью или коротким мостиком (на диаграмме окрашены в пурпурный цвет). Как и ожидалось, полученные производные аннулена с 10 π-электронами проявляют ароматическую стабильность и реакционную способность, а также характерную анизотропию кольцевого тока в ЯМР.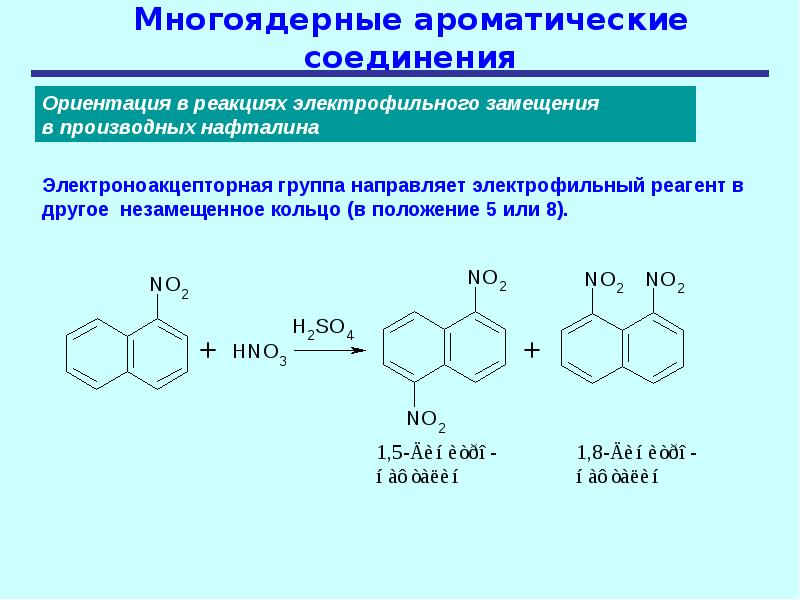 Нафталин и азулен являются аналогами [10]аннулена, стабилизированными трансаннулярной связью. Хотя СН 2 мостиковая структура справа от нафталина на диаграмме не совсем плоская, сопряженное 10 π-электронное кольцо достаточно близко к плоскостности для достижения ароматической стабилизации. Мостиковое соединение [14]аннулена в крайнем правом углу также обладает ароматическими свойствами.
Нафталин и азулен являются аналогами [10]аннулена, стабилизированными трансаннулярной связью. Хотя СН 2 мостиковая структура справа от нафталина на диаграмме не совсем плоская, сопряженное 10 π-электронное кольцо достаточно близко к плоскостности для достижения ароматической стабилизации. Мостиковое соединение [14]аннулена в крайнем правом углу также обладает ароматическими свойствами.
Баррелен
Формулировка правила Хюккеля побудила химиков-органиков рассмотреть возможную ароматичность многих необычных ненасыщенных углеводородов. Одним из таких соединений была бициклическая структура с 6 π-электронами, теперь известная как баррелен. Хотя π-связи в баррелене не компланарны, считалось, что трансаннулярное перекрытие все же может приводить к ароматической стабилизации.
Синтез баррелена (бицикло[2.2.2]-2,5,7-октатриена) был осуществлен почти пятьдесят лет назад Х. Циммерманом (Висконсин) с использованием двойного элиминирования Хофмана. Как показано на следующей диаграмме, химическое поведение этого триена подтверждает, что он не является ароматическим в общепринятом смысле этого термина. Присоединение брома происходит быстро с образованием трансаннулярной связи, так же, как и с норборнадиеном (бицикло[2.2.1]-2,5-гептадиен). Пиролиз баррелена дал ожидаемые продукты циклореверсии бензол и ацетилен.
Присоединение брома происходит быстро с образованием трансаннулярной связи, так же, как и с норборнадиеном (бицикло[2.2.1]-2,5-гептадиен). Пиролиз баррелена дал ожидаемые продукты циклореверсии бензол и ацетилен.
Теплота гидрирования баррелена отражает его термодинамическую стабильность. Значение для циклогексена составляет -28 ккал/моль, что значительно меньше одной трети барреленового числа. Кроме того, первая двойная связь баррелена восстанавливается с выделением 36,7 ккал/моль тепла, что указывает скорее на дестабилизацию, чем на стабилизацию.
Электронный спектр баррелена показывает π-электронное взаимодействие, аналогичное взаимодействию родственных гомосопряженных диенов. (λмакс ≅220-230 нм).
Объяснение отсутствия ароматического поведения в случае баррелена можно найти, сравнив орбитальную симметрию шестикомпонентных р-орбиталей с симметрией бензола. Бензол представляет собой кольцо, в котором все шесть p-орбиталей могут быть ориентированы с конгруэнтными перекрывающимися фазами. Цилиндрический массив p-орбиталей в баррелене не может быть устроен так, как показано на диаграмме справа. Всегда будет одна область (узловая плоскость), в которой трансаннулярное перекрытие неконгруэнтно. При нажатии на эту диаграмму в отдельном окне отобразится модель баррелена Jmol. Эту модель можно перемещать для просмотра. Также могут отображаться p-орбитали двойных связей.
Цилиндрический массив p-орбиталей в баррелене не может быть устроен так, как показано на диаграмме справа. Всегда будет одна область (узловая плоскость), в которой трансаннулярное перекрытие неконгруэнтно. При нажатии на эту диаграмму в отдельном окне отобразится модель баррелена Jmol. Эту модель можно перемещать для просмотра. Также могут отображаться p-орбитали двойных связей.
Ароматические ионы
Карбанионы и карбокатионы также могут проявлять ароматическую стабилизацию. Некоторые примеры:
Трехчленный кольцевой катион имеет 2 π-электрона и удивительно стабилен, учитывая его кольцевую деформацию. Циклопентадиен такой же кислый, как этанол, что отражает стабильность его сопряженного основания с 6 π-электронами. Соли циклогептатриенильного катиона (иона тропилия) стабильны в водном растворе, что опять-таки отражает стабильность этого 6-электронного катиона.
Антиароматичность
Сопряженные кольцевые системы, содержащие 4n π-электронов (например, 4, 8, 12 и т. д. электронов), не только не проявляют никаких ароматических свойств, но и менее стабильны и более реакционноспособны, чем ожидалось. Как отмечалось выше, 1,3,5,7-циклооктатетраен не является плоским и принимает форму ванны. Соединение легко получают и вступают в типичные для алкенов реакции присоединения. Каталитическое гидрирование этого тетраена дает циклооктан. Плоские мостиковые аннулены, имеющие 4n π-электронов, оказались относительно нестабильными. Примеры систем с 8 и 12 π-электронами показаны ниже вместе с аналогичным ароматическим соединением с 10 π-электронами.
д. электронов), не только не проявляют никаких ароматических свойств, но и менее стабильны и более реакционноспособны, чем ожидалось. Как отмечалось выше, 1,3,5,7-циклооктатетраен не является плоским и принимает форму ванны. Соединение легко получают и вступают в типичные для алкенов реакции присоединения. Каталитическое гидрирование этого тетраена дает циклооктан. Плоские мостиковые аннулены, имеющие 4n π-электронов, оказались относительно нестабильными. Примеры систем с 8 и 12 π-электронами показаны ниже вместе с аналогичным ароматическим соединением с 10 π-электронами.
Простой углеводородный пентален C 8 H 6 не существует в виде стабильного соединения, а его гексафенилпроизводное чувствительно к воздействию воздуха. Был получен 12-π-электронный аналог гепталена, но он также чрезвычайно реакционноспособен (более активен, чем циклооктатетраен). С другой стороны, азулен представляет собой стабильный 10-π-электронный углеводород, который включает в себя структурные черты как пенталена, так и гепталена. Азулен представляет собой стабильное синее кристаллическое твердое вещество, которое подвергается ряду типичных реакций ароматического замещения. Неожиданная нестабильность 4n π-электронных аннуленов была названа «антиароматичностью». Можно привести и другие примеры. Таким образом, все попытки выделения 1,3-циклобутадиена приводили к его димеру или продуктам взаимодействия с другими соединениями, введенными в реакционную систему. Точно так же циклопентадиенильный катион (4 π-электрона) и циклогептатриенильный анион (8 π-электронов) проявляют очень высокую реакционную способность, когда их принудительно формируют.
Азулен представляет собой стабильное синее кристаллическое твердое вещество, которое подвергается ряду типичных реакций ароматического замещения. Неожиданная нестабильность 4n π-электронных аннуленов была названа «антиароматичностью». Можно привести и другие примеры. Таким образом, все попытки выделения 1,3-циклобутадиена приводили к его димеру или продуктам взаимодействия с другими соединениями, введенными в реакционную систему. Точно так же циклопентадиенильный катион (4 π-электрона) и циклогептатриенильный анион (8 π-электронов) проявляют очень высокую реакционную способность, когда их принудительно формируют.
Вопросы
1) Какое из следующих соединений (от A до J) можно считать ароматическим в соответствии с правилом Хюккеля?
A, D, E и G
Щелкните здесь, чтобы получить ответы
2) Какое из следующих соединений (от A до J) будет считаться ароматическим при применении правила Хюккеля?
Щелкните здесь, чтобы получить ответы
Авторы
Уильям Ройш, почетный профессор (штат Мичиган, Университет штата Мичиган), Виртуальный учебник органической химии
Эта страница с заголовком «Другие ароматические системы» используется в соответствии с лицензией CC BY-NC-SA 4.