Ароматические углеводороды — Что такое Ароматические углеводороды?
AИ-95
0
AИ-98
0
207180
Ароматические углеводороды (арены) – это углеводороды, молекулы которых содержат одно или несколько бензольных колец.
Ароматические углеводороды (арены) — класс углеводородов, содержащих бензольные ядра, которые могут быть конденсированными и иметь насыщенные боковые цепи.
К наиболее важным аренам относятся бензол (С6Н6) и его гомологи.
Это углеводороды, молекулы которых содержат 1 или несколько бензольных колец, и другие углеводородные группы (алифатические, нафтеновые, полициклические).
Простейшим представителем ароматических углеводородов является бензол, молекулярная формула которого С
Установлено, что все атомы углерода в молекуле бензола лежат в одной плоскости, образуя правильный 6-угольник .
Каждый атом углерода связан с одним атомом водорода.
Длины всех связей углерод-углерод одинаковы и составляют 0,139 нм.
Для передачи строение молекулы бензола используют формулы Кекуле, которые предложил в 1865 г. немецкий химик Август Кекуле.
Важными аренами являются и гомологи бензола (толуол С6Н5СНз, ксилолы С6Н4(СНз)2, дурол, мезитилен, этилбензол), кумол, нафталин C10H8, антрацен С14Н10 и их производные.
Ароматические углеводороды — исходное сырье для промышленного получения кетонов, альдегидов и кислот ароматического ряда, и других веществ.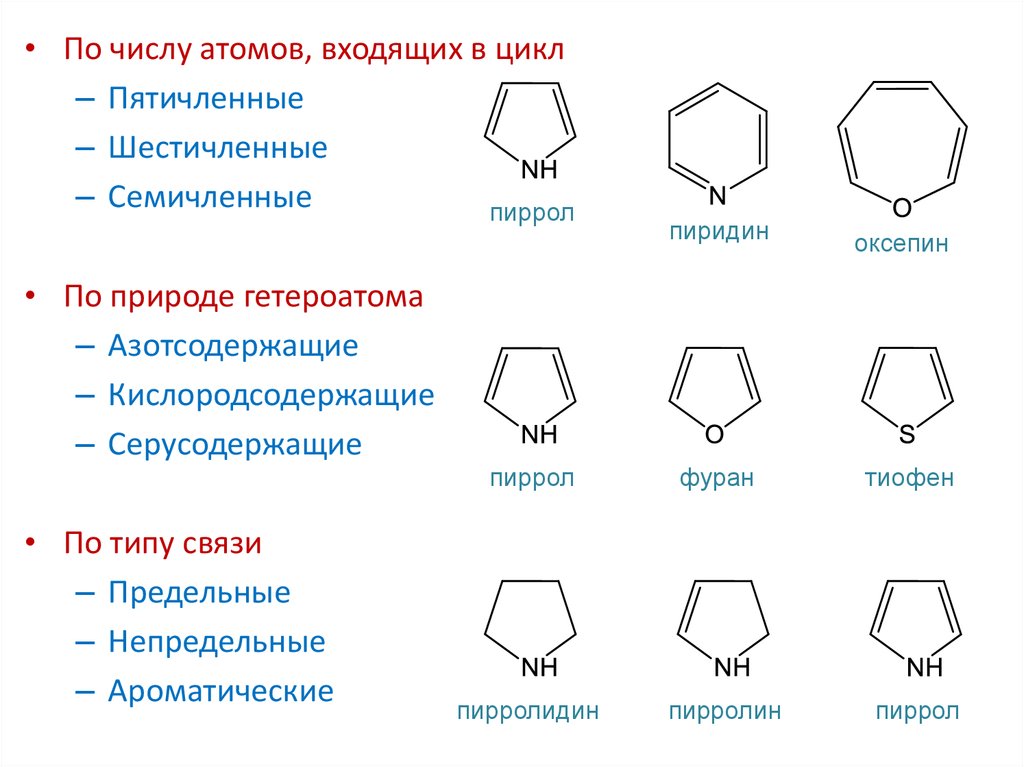
Исторически название «ароматические углеводороды» сложилось потому, что многие производные бензола, которые первыми были выделены из природных источников, обладали приятным запахом.
В настоящее время под понятием «ароматичность» подразумевают, прежде всего, особый характер реакционной способности веществ, обусловленный, в свою очередь, особенностями строения молекул этих соединений.
В чем же состоят эти особенности?
В соответствии с молекулярной формулой С6Н6 бензол является ненасыщенным соединением, и можно ожидать, что для него были бы характерны типичные для алкенов реакции присоединения.
Однако в условиях, в которых алкены быстро вступают в реакции присоединения, бензол не реагирует или реагирует медленно.
Бензол не дает и характерных качественных реакций, свойственных непредельным углеводородам: он не обесцвечивает бромную воду и водный раствор перманганата калия.
Такой характер реакционной способности объясняется наличием в ароматическом кольце сопряженной системы — единого «пи»-электронного облака.
#Ароматические #углеводороды #арены #молекулы #бензольное #кольцо
Последние новости
Новости СМИ2
Произвольные записи из технической библиотеки
Используя данный сайт, вы даете согласие на использование файлов cookie, помогающих нам сделать его удобнее для вас. Подробнее.
Ароматические соединения | это… Что такое Ароматические соединения?
Запрос «Арены» перенаправляется сюда; см. также другие значения.
Бензол — одно из наиболее распространённых ароматических соединенийАроматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения.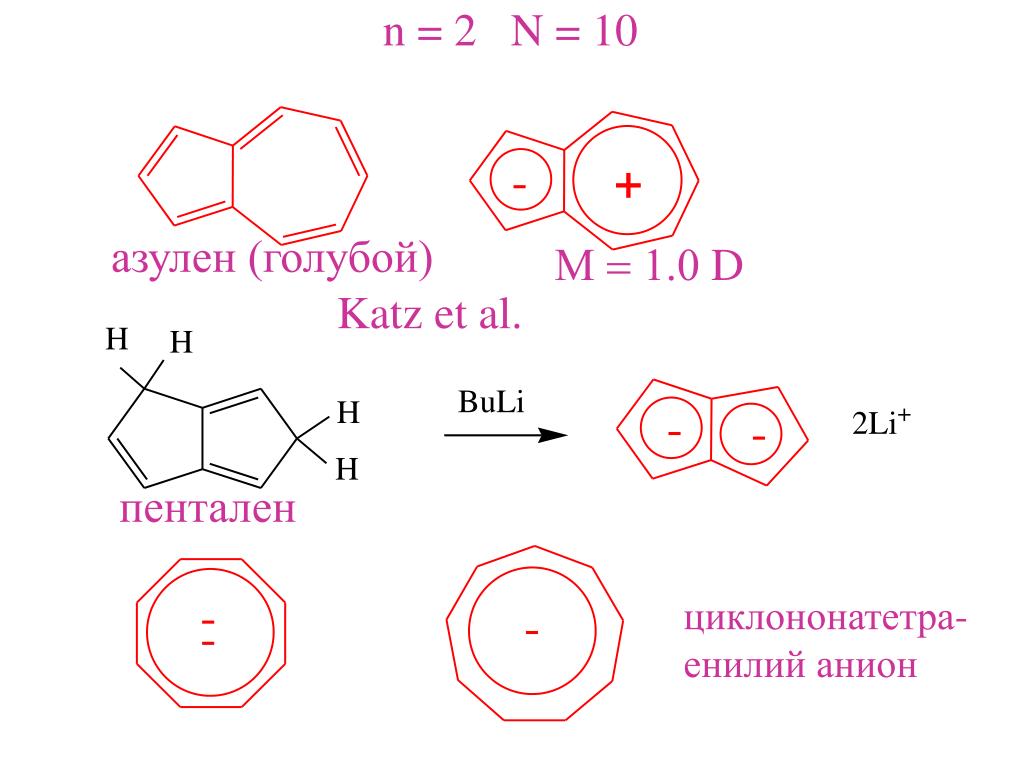
Различают бензоидные (арены и структурные производные аренов, содержат бензольные ядра) и небензоидные (все остальные) ароматические соединения. Среди небензоидных ароматических соединений хорошо известны азулен, аннулены, гетарены (пиридин, пиррол, фуран, тиофен), ферроцен. Известны и неорганические ароматические соединения, например боразол («неорганический бензол»).
В структуре молекул многих соединений можно выделить несколько ароматических систем, которые могут быть по отношению друг к другу изолированными либо конденсированными. В качестве примеров бензоидных соединений с изолированными бензольными ядрами можно назвать такие соединения как дифенилметан и полистирол, с удалёнными друг от друга бензольные ядра, а также дифенил и терфенилы с непосредственно связанными ядрами. Примерами бензоидных соединений с конденсированными (аннелированными) бензольными ядрами являются такие соединения как нафталин, пирен и прочие ПАУ. В структуре дифенилена бензольные ядра непосредственно связаны друг с другом, но, в отличие от дифенила, у дифенилена бензольные ядра не являются изолированными.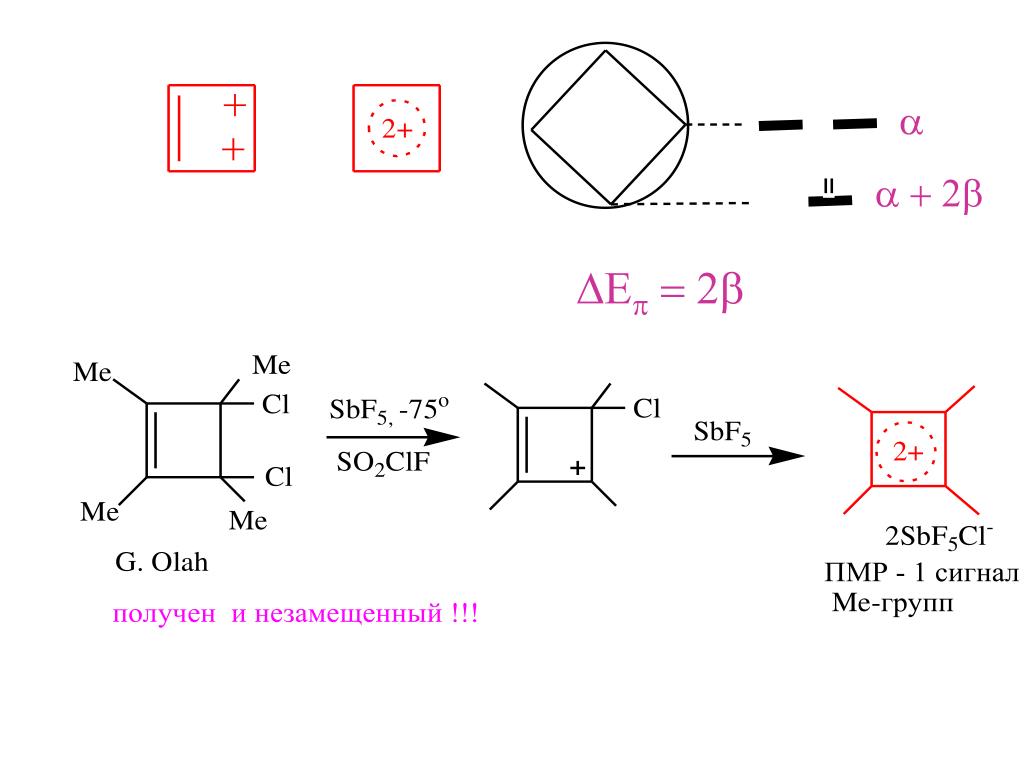
Широко распространены и имеют большое практическое значение бензоидные ароматические углеводороды (арены). Помимо бензольных колец арены часто содержат другие разнообразные углеводородные группы (алифатические, нафтеновые, полициклические). Основным источником получения ароматических углеводородов служат каменноугольная смола, нефть и нефтепродукты. Большое значение имеют синтетические методы получения. Наиболее важными аренами являются: бензол С 6Н6 и его гомологи (толуол С6Н5СНз, ксилолы С6Н4(СНз)2, дурол, мезитилен, этилбензол), кумол, нафталин C10H8, антрацен С14Н10 и их производные. Ароматические углеводороды — исходное сырьё для промышленного получения кетонов, альдегидов и кислот ароматического ряда, а также многих других веществ.
Ароматические углеводороды — исходное сырьё для промышленного получения кетонов, альдегидов и кислот ароматического ряда, а также многих других веществ.
Содержание
|
Критерии ароматичности
Единой характеристики, позволяющей надежно классифицировать соединение как ароматическое или неароматическое не существует. Основными характеристиками ароматических соединений являются:
- склонность к реакциям замещения, а не присоединения (определяется легче всего, исторически первый признак, пример — бензол, в отличие от этилена не обесцвечивает бромную воду)
- выигрыш по энергии, в сравнении с системой несопряженных двойных связей. Также называется Энергией Резонанса (усовершенствованный метод — Энергией Резонанса Дьюара) (выигрыш настолько велик, что молекула претерпевает значительные преобразования для достижения ароматичного состояния, например циклогексадиен легко дегидрируется до бензола, двух и трехатомные фенолы существуют преимущественно в форме фенолов (енолов), а не кетонов и.
 т.д.).
т.д.). - наличие кольцевого магнитного тока (наблюдение требует сложной аппаратуры), этот ток обеспечивает смещение хим-сдвигов протонов, связанных с ароматическим кольцом в слабое поле (7-8 м.д. для бензольного кольца), а протонов расположенных над/под плоскостью ароматической системы — в сильное поле (спектр ЯМР).
- наличие самой плоскости (минимально искаженной), в которой лежат все (либо не все — гомоароматичность) атомы образующие ароматическую систему. При этом кольца пи-электронов, образующиеся при сопряжении двойных связей (либо электронов входящих в кольцо гетероатомов) лежат над и под плоскостью ароматической системы.
- практически всегда соблюдается Правило Хюккеля: ароматичной может быть лишь система, содержащая (в кольце) 4n+2 электронов (где n = 0, 1, 2, …). Система, содержащая 4n электронов является антиароматичной (в упрощенном понимании это обозначает избыток энергии в молекуле, неравенство длин связей, низкая стабильность — склонность к реакциям присоединения).

Получение
- Каталитическая дегидроциклизация алканов, то есть отщепление водорода с одновременной циклизацией. Реакция осуществляется при повышенной температуре с использованием катализатора, например оксида хрома.
- Каталитическое дегидрирование циклогексана и его производных. В качестве катализатора используется палладиевая чернь или платина при 300 °C. (Н. Д. Зелинский)
- Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600 °C.
 (Н. Д. Зелинский)
(Н. Д. Зелинский) - Алкилирование бензола галогенопроизводными или олефинами. (Реакция Фриделя — Крафтса)
Классификация
В общих чертах ароматические углеводороды можно классифицировать следующим образом:
Системы с 2 π-электронами.
Представлены производными катиона циклопропенилия и дикатион циклобутадиена. Например перхлорат циклопропенилия.
Системы с 6 π-электронами.
- Бензол и его гомологи
- Циклопентадиенил-анион
- Циклогептатриенил-катион
- Дианион циклобутадиена, дикатион циклооктатетраена
- Пяти- и шестичленные циклы, содержащие один или несколько гетероатомов, обычно азота, кислорода или серы. Наиболее известны среди них пиррол, фуран, тиофен, пиридин.
Системы с 10 π-электронами.
- Нафталин. Широко встречается в природе, конденсированные бензольные кольца.
- Азулен. Изомер нафталина, содержит в себе 5- и 7-членное кольца. Встречается в эфирных маслах.

- Дианион циклооктатетраена, анион циклононатетраена, азонин, 1,6-замещенные-[10]-аннулены (мостиковые).
- Индол, хинолин, изохинолин, хиназолин, хиноксалин, другие системы, основанные на бензольном кольце, конденсированном с другим кольцом, в котором находится гетероатом. Широко распространены в природе.
- Хинолизидин, пирролизидин, пурин, птеридин (их аналоги) — бициклические производные пиррола, пиридина и т. д. Содержат атомы азота (реже — кислорода в точке сопряжения либо несколько гетероатомов, в обоих кольцах). Широко распространены в природе.
Системы с 14 π-электронами.
- Антрацен, фенантрен, в определенном смысле — фенален — конденсированные бензольные кольца. Соединения такого типа называют полиценами (следующий — тетрацен).
- [14]-аннулен. Как сам по себе, так и его мостиковые вариации (транс-15,16-диметилгидропирен, син-1,6:8,13-бисоксидо[14]аннулен). Также ароматичен дегидро[14]аннулен.
Системы с более чем 14 π-электронами.
- 18-Аннулен, кекулен[1].
- Коронен — ароматически полициклический углеводород, содержащий 24 π-электрона, что означает по правилу Хюккеля его антиароматичность. Однако π-электронная система коронена состоит из двух концентрических колец, содержащих 18 (внешнее) и 6 (внутреннее) электронов[2].
Гомоароматичные системы
Один из атомов кольца, которое не может расположиться в плоскости, резко выведен из этой плоскости, сохраняет sp³-гибридизацию и не участвует в сопряжении. Так, при растворении циклооктатетраена в серной кислоте образуется гомотропилиевый ион. Аналогичную структуру имеет трисгомоциклопропенильный катион
Сидноны
И прочие мезоионные соединения. Принадлежность сиднонов к ароматическим соединениям так и не была однозначно принята всеми учеными (предлагал В. Бекер). Впрочем единственный протон, связанный с углеродом, вступает во многие реакции, характерные для аренов (нитрование, сульфирование, хлорирование, меркурирование и. т.д.), а сам сиднон содержит циклическую систему пи-орбиталей.
т.д.), а сам сиднон содержит циклическую систему пи-орбиталей.
Спироароматические системы
Представитель — [4,2]спирарен. Подчиняется правилу Хюккеля.
Свойства
Как правило, ароматические соединения — твердые или жидкие вещества. Отличаются от алифатических и алициклических аналогов высокими показателями преломления и поглощения в близкой УФ и видимой области спектра. Для ароматических соединений характерны реакции замещения, как электрофильного (галогенирование, нитрование, сульфирование, алкилирование, ацилирование, др.), так и нуклеофильного (по различным механизмам). Возможны реакции присоединения, окисления (для моноядерных аренов — в весьма жестких условиях и/или с катализаторами).
Примечания
- ↑ Дж. Марч. Органическая Химия. Реакции, механизмы и структура. 1 том. с 88
- ↑ Терней А. Л. Современная органическая химия. т.1. с. 578.
Литература
- Дж. Марч. Органическая Химия. Реакции, механизмы и структура.
 1 том.
1 том. - Керри. Сандберг. Органическая химия. Механизмы реакций. 1 том.
- Химическая Энциклопедия в 5 томах. ред. И. Л. Кнунянц. 1 том.
| Органическая химия |
|---|
Ароматичность | Ковалентная связь | Функциональная группа | Номенклатура ИЮПАК | Органическое соединение | Органическая реакция | Органический синтез | Список публикаций по органической химии | Спектроскопия | Стереохимия |
| Список органических соединений |
Ароматические системы и факторы, необходимые для ароматичности
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1198
- William Reusch
- Университет штата Мичиган
Многие ненасыщенные циклические соединения обладают исключительными свойствами, которые мы теперь считаем характерными для «ароматических» систем. Показательны следующие случаи:
Показательны следующие случаи:
| Соединение | Структурный Формула | Реакция с Br 2 | Термодинамический Стабилизация |
|---|---|---|---|
| 1,3-циклопентадиен | Добавление (0 ºC) | Легкий | |
| 1,3,5-Циклогептатриен | Добавление (0 ºC) | Легкий | |
| 1,3,5,7-циклооктатетраен | Добавление (0 ºC) | Легкий | |
| Бензол | Замена | Большой | |
| Пиридин | Замена | Большой | |
| Фуран | Замена (0 ºC) | Умеренный | |
| Пиррол | Замена | Умеренный |
Первые три соединения (циклические полиены) обладают свойствами, связанными с алкенами в целом. Каждый из них легко реагирует с бромом с образованием продуктов присоединения, как и большинство алкенов. Термодинамическое изменение при введении двойных связей в кольцо атома углерода также типично для алкенов (дестабилизация около 26 ккал/моль на каждую двойную связь). Конъюгация компенсирует это увеличение энергии на небольшое количество (4-6 ккал/моль).
Каждый из них легко реагирует с бромом с образованием продуктов присоединения, как и большинство алкенов. Термодинамическое изменение при введении двойных связей в кольцо атома углерода также типично для алкенов (дестабилизация около 26 ккал/моль на каждую двойную связь). Конъюгация компенсирует это увеличение энергии на небольшое количество (4-6 ккал/моль).
Остальные четыре соединения обладают очень разными свойствами и считаются ароматическими. Бензол и пиридин относительно не вступают в реакцию с бромом, для ускорения реакции требуется тепло и/или катализаторы, результатом которых является замещение, а не присоединение. Фуран и пиррол быстрее реагируют с бромом, но также дают продукты замещения. Эта тенденция отдавать предпочтение замещению, а не добавлению, предполагает, что исходная ненасыщенная кольцевая система обладает исключительной стабильностью. Термодинамические измерения подтверждают этот вывод. Повышенная стабильность, часто называемая ароматическая стабилизация колеблется (в приведенных выше случаях) от 16 ккал/моль для фурана до 36 ккал/моль для бензола.
Факторы, необходимые для ароматичности
- Плоский (или почти плоский) цикл sp 2 гибридизованных атомов, р-орбитали которых ориентированы параллельно друг другу. Эти перекрывающиеся p-орбитали образуют массив π-молекулярных орбиталей.
- Эти π-орбитали заняты 4n+2 электронами (где n — целое число или ноль). Это требование известно как Правило Хюккеля . Все рассмотренные выше ароматические соединения имеют 6 π-электронов (n=1).
1,3-Циклопентадиен и 1,3,5-циклогептатриен не удовлетворяют первому требованию, поскольку один атом углерода каждого кольца находится в состоянии sp 3 гибридизации и не имеет р-орбитали. Циклооктатетраен не удовлетворяет обоим требованиям, хотя и имеет кольцо из sp 2 гибридизованных атомов. Эта молекула не плоская (геометрия, которая имеет валентные углы 135º). Угловая деформация снимается за счет принятия конформации в форме ванны; следовательно, p-орбитали могут перекрываться только изолированными парами, а не по всему кольцу. Кроме того, циклооктатетраен имеет 8 π-электронов, что не соответствует правилу Хюккеля.
Кроме того, циклооктатетраен имеет 8 π-электронов, что не соответствует правилу Хюккеля.
Бензол является типичным ароматическим соединением. Оно плоское, валентные углы = 120º, все атомы углерода в кольце sp 2 гибридизованы, а пи-орбитали заняты 6 электронами. Ароматический гетероцикл пиридин похож на бензол и часто используется в качестве слабого основания для поглощения протонов. Фуран и пиррол имеют гетероциклические пятичленные кольца, в которых гетероатом имеет по крайней мере одну пару несвязывающих электронов валентной оболочки. Путем гибридизации этого гетероатома с sp 2 9В состоянии 0125 создается p-орбиталь, занятая парой электронов и ориентированная параллельно углеродным p-орбиталям. Полученное плоское кольцо удовлетворяет первому требованию ароматичности, а π-система занята 6 электронами, 4 от двух двойных связей и 2 от гетероатома, что удовлетворяет правилу Хюккеля.
Выше показаны четыре показательных примера ароматических соединений. Атомы гибридизованного кольца sp 2 соединены коричневыми связями, π-электронные пары и связи, составляющие ароматическое кольцо, окрашены в синий цвет. Электронные пары, не входящие в состав ароматической π-электронной системы, окрашены в черный цвет. Первым примером является азулен, ароматический углеводород с 10 π-электронами синего цвета, изомерный с нафталином. Второе и третье соединения представляют собой гетероциклы, обладающие ароматическими свойствами. Пиридин имеет бензольное шестичленное кольцо, включающее один атом азота. Несвязывающая электронная пара азота не является частью ароматического секстета π-электронов и может связываться с протоном или другим электрофилом, не разрушая ароматическую систему. В случае тиофена, сернистого аналога фурана, одна из электронных пар серы (окрашена синим цветом) участвует в π-электронном сопряжении ароматического кольца. Последнее соединение представляет собой имидазол, гетероцикл с двумя атомами азота. Обратите внимание, что только одна из несвязывающих электронных пар азота используется для секстета ароматических π-электронов.
Атомы гибридизованного кольца sp 2 соединены коричневыми связями, π-электронные пары и связи, составляющие ароматическое кольцо, окрашены в синий цвет. Электронные пары, не входящие в состав ароматической π-электронной системы, окрашены в черный цвет. Первым примером является азулен, ароматический углеводород с 10 π-электронами синего цвета, изомерный с нафталином. Второе и третье соединения представляют собой гетероциклы, обладающие ароматическими свойствами. Пиридин имеет бензольное шестичленное кольцо, включающее один атом азота. Несвязывающая электронная пара азота не является частью ароматического секстета π-электронов и может связываться с протоном или другим электрофилом, не разрушая ароматическую систему. В случае тиофена, сернистого аналога фурана, одна из электронных пар серы (окрашена синим цветом) участвует в π-электронном сопряжении ароматического кольца. Последнее соединение представляет собой имидазол, гетероцикл с двумя атомами азота. Обратите внимание, что только одна из несвязывающих электронных пар азота используется для секстета ароматических π-электронов. Другая электронная пара (закрашенная черным цветом) ведет себя аналогично электронной паре в пиридине.
Другая электронная пара (закрашенная черным цветом) ведет себя аналогично электронной паре в пиридине.
Аннулены
Моноциклические соединения, состоящие из чередующихся сопряженных двойных связей, называются аннуленами . Примерами аннуленов являются бензол и 1,3,5,7-циклооктатетраен; они называются [6]аннулен и [8]аннулен соответственно в соответствии с общей номенклатурной системой, в которой число пи-электронов в аннулене обозначается числом в скобках. Некоторые аннулены являются ароматическими (например, бензол), но многие из них не из-за непланарности или несоблюдения правила Хюккеля. Соединения, классифицируемые как [10]аннулены (система правил Хюккеля), служат иллюстрацией этих факторов.
Как показано на следующей диаграмме, 1,3,5,7,9-циклодекапентаен не может принять плоскую конформацию ни во всей цис-конфигурации, ни в своей 1,5-транс-изомерной форме. Трансаннулярное скопление водорода, дестабилизирующее последний, можно устранить, заменив внутренние атомы водорода связью или коротким мостиком (окрашены пурпурным цветом на диаграмме). Как и ожидалось, полученные производные аннулена с 10 π-электронами проявляют ароматическую стабильность и реакционную способность, а также характерную анизотропию кольцевого тока в ЯМР. Нафталин и азулен являются аналогами [10]аннулена, стабилизированными трансаннулярной связью. Хотя СН 2 мостиковая структура справа от нафталина на диаграмме не совсем плоская, сопряженное 10 π-электронное кольцо достаточно близко к плоскостности для достижения ароматической стабилизации. Мостиковое соединение [14]аннулена в крайнем правом углу также обладает ароматическими свойствами.
Как и ожидалось, полученные производные аннулена с 10 π-электронами проявляют ароматическую стабильность и реакционную способность, а также характерную анизотропию кольцевого тока в ЯМР. Нафталин и азулен являются аналогами [10]аннулена, стабилизированными трансаннулярной связью. Хотя СН 2 мостиковая структура справа от нафталина на диаграмме не совсем плоская, сопряженное 10 π-электронное кольцо достаточно близко к плоскостности для достижения ароматической стабилизации. Мостиковое соединение [14]аннулена в крайнем правом углу также обладает ароматическими свойствами.
Недавно химиками Калифорнийского технологического института был получен модифицированный [10]аннулен, ароматический по критериям ЯМР. Примечательно, что этот углеводород химически нестабилен, в отличие от большинства других ароматических углеводородов.
Barrelene
Формулировка правила Хюккеля побудила химиков-органиков рассмотреть возможную ароматичность многих необычных ненасыщенных углеводородов.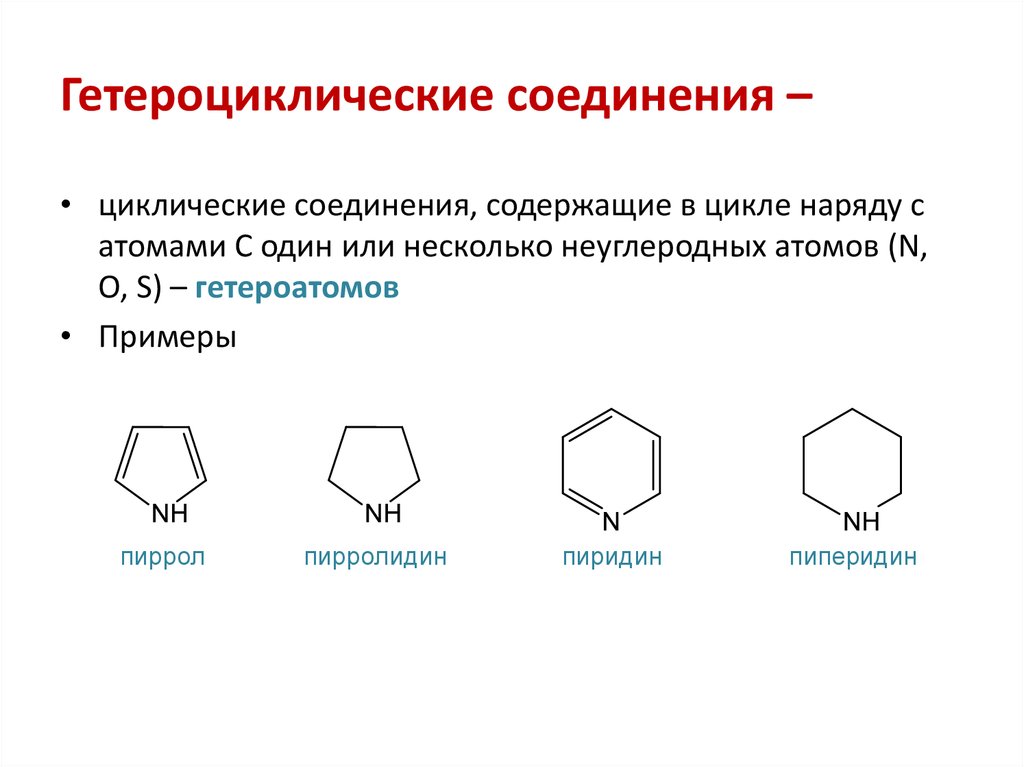 Одним из таких соединений была бициклическая структура с 6 π-электронами, теперь известная как баррелен. Хотя π-связи в баррелене не компланарны, считалось, что трансаннулярное перекрытие все же может приводить к ароматической стабилизации.
Одним из таких соединений была бициклическая структура с 6 π-электронами, теперь известная как баррелен. Хотя π-связи в баррелене не компланарны, считалось, что трансаннулярное перекрытие все же может приводить к ароматической стабилизации.
Синтез баррелена (бицикло[2.2.2]-2,5,7-октатриена) был осуществлен почти пятьдесят лет назад Х. Циммерманом (Висконсин) с использованием двойного элиминирования Хофмана. Как показано на следующей диаграмме, химическое поведение этого триена подтверждает, что он не является ароматическим в общепринятом смысле этого термина. Присоединение брома происходит быстро с образованием трансаннулярной связи, так же, как и с норборнадиеном (бицикло[2.2.1]-2,5-гептадиен). Пиролиз баррелена дал ожидаемые продукты циклореверсии бензол и ацетилен.
Теплота гидрирования баррелена отражает его термодинамическую стабильность. Значение для циклогексена составляет -28 ккал/моль, что значительно меньше одной трети барреленового числа. Кроме того, первая двойная связь баррелена восстанавливается с выделением 36,7 ккал/моль тепла, что указывает скорее на дестабилизацию, чем на стабилизацию. Электронный спектр баррелена показывает взаимодействие π-электронов, аналогичное взаимодействию родственных гомосопряженных диенов. (λ max ≅220-230 нм).
Кроме того, первая двойная связь баррелена восстанавливается с выделением 36,7 ккал/моль тепла, что указывает скорее на дестабилизацию, чем на стабилизацию. Электронный спектр баррелена показывает взаимодействие π-электронов, аналогичное взаимодействию родственных гомосопряженных диенов. (λ max ≅220-230 нм).
Объяснение отсутствия ароматического поведения в случае баррелена можно найти, сравнив орбитальную симметрию шестикомпонентных р-орбиталей с симметрией бензола. Бензол представляет собой кольцо, в котором все шесть p-орбиталей могут быть ориентированы с конгруэнтными перекрывающимися фазами. Цилиндрический массив p-орбиталей в баррелене не может быть устроен так, как показано на диаграмме справа. Всегда будет одна область (узловая плоскость), в которой трансаннулярное перекрытие неконгруэнтно. При нажатии на эту диаграмму в отдельном окне отобразится модель баррелена Jmol. Эту модель можно перемещать для просмотра. Также могут отображаться p-орбитали двойных связей.
Авторы
- Уильям Реуш, почетный профессор (штат Мичиган, Университет штата Мичиган), Виртуальный учебник органической химии
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Уильям Ройш
- Показать страницу TOC
- № на стр.
- Теги
Другие ароматические системы – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 6148
- Уильям Ройш
- Университет штата Мичиган
Введение
Многие ненасыщенные циклические соединения обладают исключительными свойствами, которые мы теперь считаем характерными для «ароматических» систем.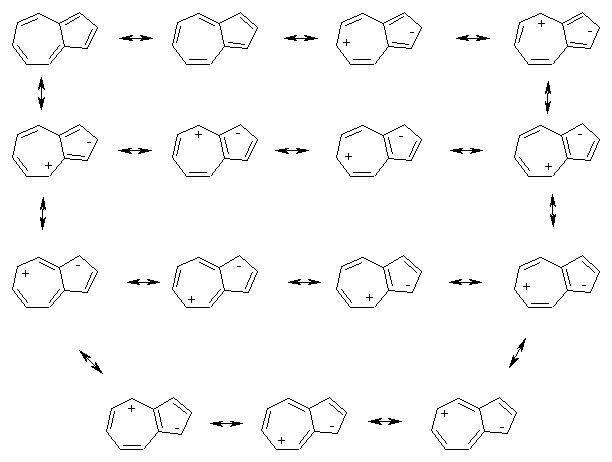 Показательны следующие случаи:
Показательны следующие случаи:
Соединение | Структурный | Реакция | Термодинамический |
|---|---|---|---|
1,3-Циклопентадиен | Добавление (0 ºC) | Легкий | |
1,3,5-циклогептатриен | Добавление (0 ºC) | Легкий | |
1,3,5,7-циклооктатетраен | Добавление (0 ºC) | Легкий | |
Бензол | Замена | Большой | |
Пиридин | Замена | Большой | |
Фуран | Замена (0 ºC) | Умеренный | |
Пиррол | Замена | Умеренный |
Первые три соединения (циклические полиены) в целом обладают свойствами, связанными с алкенами.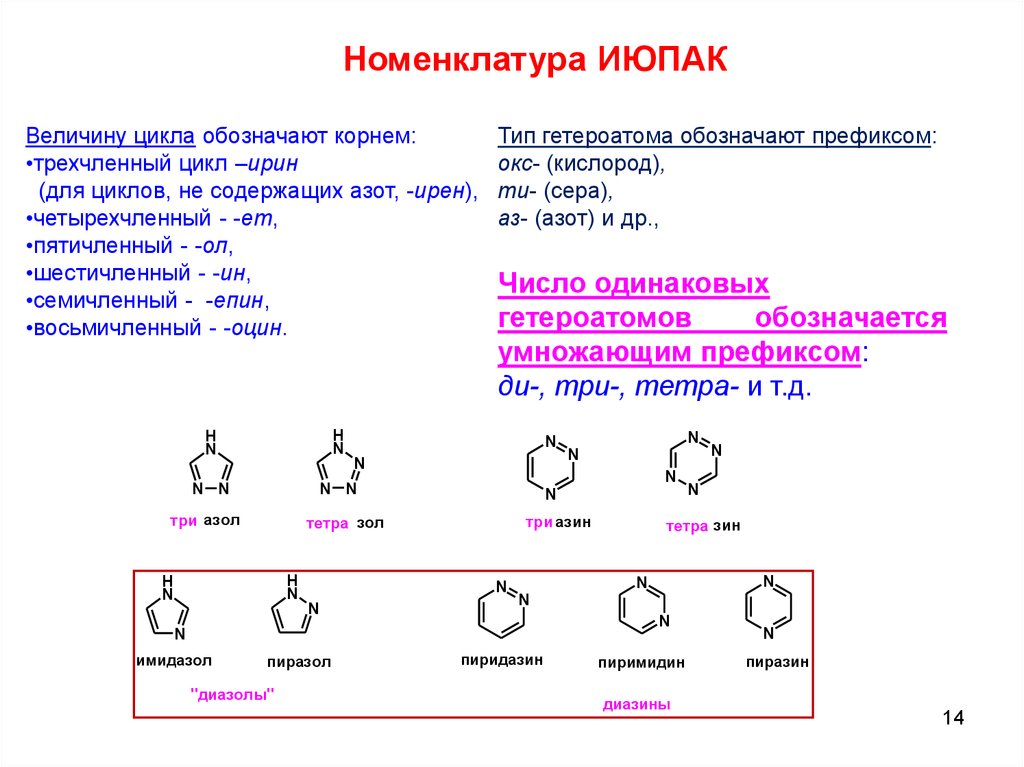 Каждый из них легко реагирует с бромом с образованием продуктов присоединения, как и большинство алкенов. Термодинамическое изменение при введении двойных связей в кольцо атома углерода также типично для алкенов (дестабилизация около 26 ккал/моль на каждую двойную связь). Конъюгация компенсирует это увеличение энергии на небольшое количество (4-6 ккал/моль).
Каждый из них легко реагирует с бромом с образованием продуктов присоединения, как и большинство алкенов. Термодинамическое изменение при введении двойных связей в кольцо атома углерода также типично для алкенов (дестабилизация около 26 ккал/моль на каждую двойную связь). Конъюгация компенсирует это увеличение энергии на небольшое количество (4-6 ккал/моль).
Остальные четыре соединения обладают очень разными свойствами и считаются ароматическими. Бензол и пиридин относительно не вступают в реакцию с бромом, для ускорения реакции требуется тепло и/или катализаторы, результатом которых является замещение, а не присоединение. Фуран и пиррол быстрее реагируют с бромом, но также дают продукты замещения. Эта тенденция отдавать предпочтение замещению, а не добавлению, предполагает, что исходная ненасыщенная кольцевая система обладает исключительной стабильностью. Термодинамические измерения подтверждают этот вывод. Повышенная стабильность, часто называемая ароматической стабилизацией, находится в диапазоне (в приведенных выше случаях) от 16 ккал/моль для фурана до 36 ккал/моль для бензола.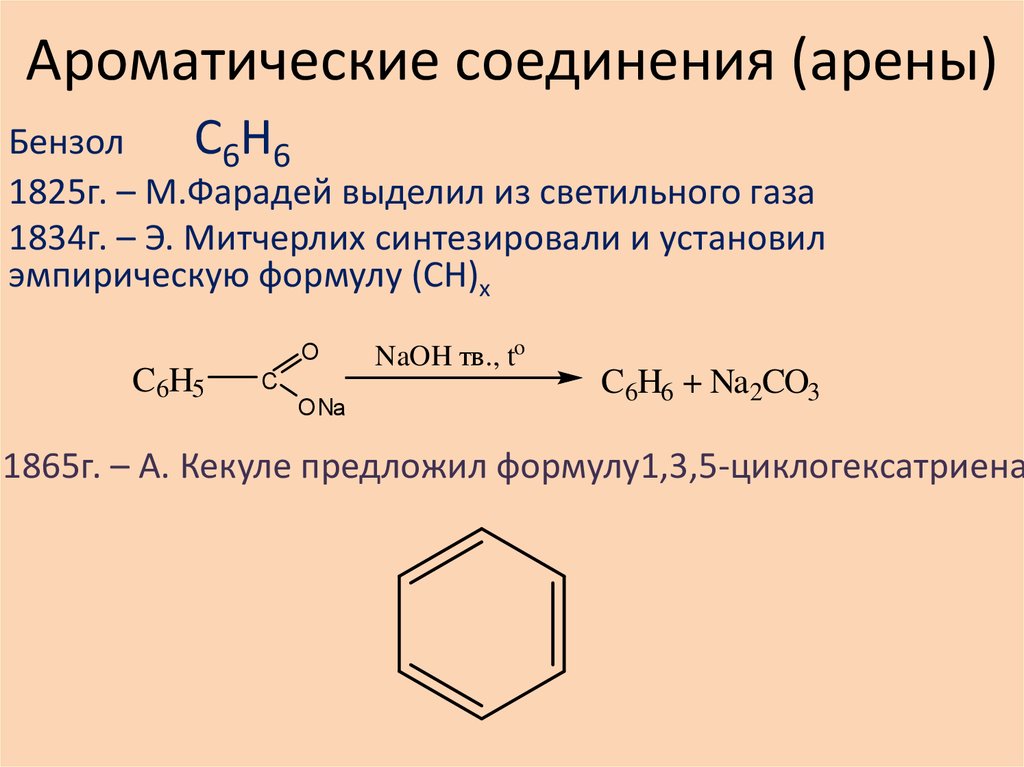
Факторы, необходимые для ароматичности
Плоский (или почти плоский) цикл sp 2 гибридизованных атомов, p-орбитали которых ориентированы параллельно друг другу. Эти перекрывающиеся p-орбитали образуют массив π-молекулярных орбиталей.
Эти π-орбитали заняты 4n+2 электронами (где n — целое число или ноль). Это требование известно как правило Хюккеля. Все рассмотренные выше ароматические соединения имеют 6 π-электронов (n=1).
1,3-Циклопентадиен и 1,3,5-циклогептатриен не удовлетворяют первому требованию, поскольку один атом углерода в каждом кольце имеет sp 3 гибридизован и не имеет р-орбитали. Циклооктатетраен не удовлетворяет обоим требованиям, хотя и имеет кольцо из sp 2 гибридизованных атомов. Эта молекула не плоская (геометрия, которая имеет валентные углы 135º). Угловая деформация снимается за счет принятия конформации в форме ванны; следовательно, p-орбитали могут перекрываться только изолированными парами, а не по всему кольцу. Кроме того, циклооктатетраен имеет 8 π-электронов, что не соответствует правилу Хюккеля.
Кроме того, циклооктатетраен имеет 8 π-электронов, что не соответствует правилу Хюккеля.
Бензол является типичным ароматическим соединением. Оно плоское, валентные углы = 120º, все атомы углерода в кольце имеют sp 2 гибридизуются, а пи-орбитали заняты 6 электронами. Ароматический гетероцикл пиридин похож на бензол и часто используется в качестве слабого основания для поглощения протонов. Фуран и пиррол имеют гетероциклические пятичленные кольца, в которых гетероатом имеет по крайней мере одну пару несвязывающих электронов валентной оболочки. Путем гибридизации этого гетероатома с состоянием sp2 создается p-орбиталь, занятая парой электронов и ориентированная параллельно p-орбиталям углерода. Полученное плоское кольцо удовлетворяет первому требованию ароматичности, а π-система занята 6 электронами, 4 от двух двойных связей и 2 от гетероатома, что удовлетворяет правилу Хюккеля.
Выше показаны четыре иллюстративных примера ароматических соединений. Атомы sp2-гибридного кольца соединены коричневыми связями, π-электронные пары и связи, составляющие ароматическое кольцо, окрашены в синий цвет. Электронные пары, не входящие в состав ароматической π-электронной системы, окрашены в черный цвет. Первым примером является азулен, ароматический углеводород с 10 π-электронами синего цвета, изомерный с нафталином. Второе и третье соединения представляют собой гетероциклы, обладающие ароматическими свойствами. Пиридин имеет бензольное шестичленное кольцо, включающее один атом азота. Несвязывающая электронная пара азота не является частью ароматического секстета π-электронов и может связываться с протоном или другим электрофилом, не разрушая ароматическую систему. В случае тиофена, сернистого аналога фурана, одна из электронных пар серы (окрашена синим цветом) участвует в π-электронном сопряжении ароматического кольца. Последнее соединение представляет собой имидазол, гетероцикл с двумя атомами азота. Обратите внимание, что только одна из несвязывающих электронных пар азота используется для секстета ароматических π-электронов. Другая электронная пара (закрашенная черным цветом) ведет себя аналогично электронной паре в пиридине.
Электронные пары, не входящие в состав ароматической π-электронной системы, окрашены в черный цвет. Первым примером является азулен, ароматический углеводород с 10 π-электронами синего цвета, изомерный с нафталином. Второе и третье соединения представляют собой гетероциклы, обладающие ароматическими свойствами. Пиридин имеет бензольное шестичленное кольцо, включающее один атом азота. Несвязывающая электронная пара азота не является частью ароматического секстета π-электронов и может связываться с протоном или другим электрофилом, не разрушая ароматическую систему. В случае тиофена, сернистого аналога фурана, одна из электронных пар серы (окрашена синим цветом) участвует в π-электронном сопряжении ароматического кольца. Последнее соединение представляет собой имидазол, гетероцикл с двумя атомами азота. Обратите внимание, что только одна из несвязывающих электронных пар азота используется для секстета ароматических π-электронов. Другая электронная пара (закрашенная черным цветом) ведет себя аналогично электронной паре в пиридине.
Аннулены
Моноциклические соединения, состоящие из чередующихся сопряженных двойных связей, называются аннуленами. Примерами аннуленов являются бензол и 1,3,5,7-циклооктатетраен; они называются [6]аннулен и [8]аннулен соответственно в соответствии с общей номенклатурной системой, в которой число пи-электронов в аннулене обозначается числом в скобках. Некоторые аннулены являются ароматическими (например, бензол), но многие из них не из-за непланарности или несоблюдения правила Хюккеля. Соединения, классифицируемые как [10]аннулены (система правил Хюккеля), служат иллюстрацией этих факторов.
Как показано на следующей диаграмме, 1,3,5,7,9-циклодекапентаен не может принять плоскую конформацию ни во всей цис-конфигурации, ни в своей 1,5-транс-изомерной форме. Трансаннулярное скопление водорода, дестабилизирующее последний, можно устранить, заменив внутренние атомы водорода связью или коротким мостиком (окрашены пурпурным цветом на диаграмме). Как и ожидалось, полученные производные аннулена с 10 π-электронами проявляют ароматическую стабильность и реакционную способность, а также характерную анизотропию кольцевого тока в ЯМР. Нафталин и азулен являются аналогами [10]аннулена, стабилизированными трансаннулярной связью. Хотя СН 2 мостиковая структура справа от нафталина на диаграмме не совсем плоская, сопряженное 10 π-электронное кольцо достаточно близко к плоскостности для достижения ароматической стабилизации. Мостиковое соединение [14]аннулена в крайнем правом углу также обладает ароматическими свойствами.
Нафталин и азулен являются аналогами [10]аннулена, стабилизированными трансаннулярной связью. Хотя СН 2 мостиковая структура справа от нафталина на диаграмме не совсем плоская, сопряженное 10 π-электронное кольцо достаточно близко к плоскостности для достижения ароматической стабилизации. Мостиковое соединение [14]аннулена в крайнем правом углу также обладает ароматическими свойствами.
Баррелен
Формулировка правила Хюккеля побудила химиков-органиков рассмотреть возможную ароматичность многих необычных ненасыщенных углеводородов. Одним из таких соединений была бициклическая структура с 6 π-электронами, теперь известная как баррелен. Хотя π-связи в баррелене не компланарны, считалось, что трансаннулярное перекрытие все же может приводить к ароматической стабилизации.
Синтез баррелена (бицикло[2.2.2]-2,5,7-октатриена) был осуществлен почти пятьдесят лет назад Х. Циммерманом (Висконсин) с использованием двойного элиминирования Хофмана. Как показано на следующей диаграмме, химическое поведение этого триена подтверждает, что он не является ароматическим в общепринятом смысле этого термина. Присоединение брома происходит быстро с образованием трансаннулярной связи, так же, как и с норборнадиеном (бицикло[2.2.1]-2,5-гептадиен). Пиролиз баррелена дал ожидаемые продукты циклореверсии бензол и ацетилен.
Присоединение брома происходит быстро с образованием трансаннулярной связи, так же, как и с норборнадиеном (бицикло[2.2.1]-2,5-гептадиен). Пиролиз баррелена дал ожидаемые продукты циклореверсии бензол и ацетилен.
Теплота гидрирования баррелена отражает его термодинамическую стабильность. Значение для циклогексена составляет -28 ккал/моль, что значительно меньше одной трети барреленового числа. Кроме того, первая двойная связь баррелена восстанавливается с выделением 36,7 ккал/моль тепла, что указывает скорее на дестабилизацию, чем на стабилизацию.
Электронный спектр баррелена показывает π-электронное взаимодействие, аналогичное взаимодействию родственных гомосопряженных диенов. (λмакс ≅220-230 нм).
Объяснение отсутствия ароматического поведения в случае баррелена можно найти, сравнив орбитальную симметрию шестикомпонентных р-орбиталей с симметрией бензола. Бензол представляет собой кольцо, в котором все шесть p-орбиталей могут быть ориентированы с конгруэнтными перекрывающимися фазами. Цилиндрический массив p-орбиталей в баррелене не может быть устроен так, как показано на диаграмме справа. Всегда будет одна область (узловая плоскость), в которой трансаннулярное перекрытие неконгруэнтно. При нажатии на эту диаграмму в отдельном окне отобразится модель баррелена Jmol. Эту модель можно перемещать для просмотра. Также могут отображаться p-орбитали двойных связей.
Цилиндрический массив p-орбиталей в баррелене не может быть устроен так, как показано на диаграмме справа. Всегда будет одна область (узловая плоскость), в которой трансаннулярное перекрытие неконгруэнтно. При нажатии на эту диаграмму в отдельном окне отобразится модель баррелена Jmol. Эту модель можно перемещать для просмотра. Также могут отображаться p-орбитали двойных связей.
Ароматические ионы
Карбанионы и карбокатионы также могут проявлять ароматическую стабилизацию. Некоторые примеры:
Трехчленный кольцевой катион имеет 2 π-электрона и удивительно стабилен, учитывая его кольцевую деформацию. Циклопентадиен такой же кислый, как этанол, что отражает стабильность его сопряженного основания с 6 π-электронами. Соли циклогептатриенильного катиона (иона тропилия) стабильны в водном растворе, что опять-таки отражает стабильность этого 6-электронного катиона.
Антиароматичность
Сопряженные кольцевые системы, содержащие 4n π-электронов (например, 4, 8, 12 и т. д. электронов), не только не проявляют никаких ароматических свойств, но и менее стабильны и более реакционноспособны, чем ожидалось. Как отмечалось выше, 1,3,5,7-циклооктатетраен не является плоским и принимает форму ванны. Соединение легко получают и вступают в типичные для алкенов реакции присоединения. Каталитическое гидрирование этого тетраена дает циклооктан. Плоские мостиковые аннулены, имеющие 4n π-электронов, оказались относительно нестабильными. Примеры систем с 8 и 12 π-электронами показаны ниже вместе с аналогичным ароматическим соединением с 10 π-электронами.
д. электронов), не только не проявляют никаких ароматических свойств, но и менее стабильны и более реакционноспособны, чем ожидалось. Как отмечалось выше, 1,3,5,7-циклооктатетраен не является плоским и принимает форму ванны. Соединение легко получают и вступают в типичные для алкенов реакции присоединения. Каталитическое гидрирование этого тетраена дает циклооктан. Плоские мостиковые аннулены, имеющие 4n π-электронов, оказались относительно нестабильными. Примеры систем с 8 и 12 π-электронами показаны ниже вместе с аналогичным ароматическим соединением с 10 π-электронами.
Простой углеводородный пентален C 8 H 6 не существует в виде стабильного соединения, а его гексафенилпроизводное чувствительно к воздействию воздуха. Был получен 12-π-электронный аналог гепталена, но он также чрезвычайно реакционноспособен (более активен, чем циклооктатетраен). С другой стороны, азулен представляет собой стабильный 10-π-электронный углеводород, который включает в себя структурные черты как пенталена, так и гепталена. Азулен представляет собой стабильное синее кристаллическое твердое вещество, которое подвергается ряду типичных реакций ароматического замещения. Неожиданная нестабильность 4n π-электронных аннуленов была названа «антиароматичностью». Можно привести и другие примеры. Таким образом, все попытки выделения 1,3-циклобутадиена приводили к его димеру или продуктам взаимодействия с другими соединениями, введенными в реакционную систему. Точно так же циклопентадиенильный катион (4 π-электрона) и циклогептатриенильный анион (8 π-электронов) проявляют очень высокую реакционную способность, когда их принудительно формируют.
Азулен представляет собой стабильное синее кристаллическое твердое вещество, которое подвергается ряду типичных реакций ароматического замещения. Неожиданная нестабильность 4n π-электронных аннуленов была названа «антиароматичностью». Можно привести и другие примеры. Таким образом, все попытки выделения 1,3-циклобутадиена приводили к его димеру или продуктам взаимодействия с другими соединениями, введенными в реакционную систему. Точно так же циклопентадиенильный катион (4 π-электрона) и циклогептатриенильный анион (8 π-электронов) проявляют очень высокую реакционную способность, когда их принудительно формируют.
Вопросы
1) Какие из следующих соединений (от A до J) считаются ароматическими в соответствии с правилом Хюккеля?
A, D, E и G
Щелкните здесь, чтобы получить ответы
2) Какое из следующих соединений (от A до J) будет считаться ароматическим в соответствии с правилом Хюккеля?
Нажмите здесь, чтобы получить ответы
Авторы
Уильям Ройш, почетный профессор (штат Мичиган, Университет штата Мичиган), Виртуальный учебник органической химии
Эта страница под названием «Другие ароматические системы» распространяется по незаявленной лицензии, автором, ремиксом и/или куратором которой является Уильям Ройш.
