Методические рекомендации и сборник задач по физике для учащихся 8-х классов часть I (стр. 5 из 17)
Найти: m2
Анализ:
(1) — количество теплоты, которое необходимо, чтобы нагреть воду от температуры до кипения. — количество теплоты, которое выделяется при сгорании керосина.Массу воды m1 находим по формуле
.Подставляем в формулу (1)
Отсюда находим массу керосина
Вычисления:
кг.Задачи для самостоятельного решения
Задача 126. Вычислите, сколько энергии выделится при полном сгорании древесного угля массой 15 кг; керосина массой 200 г.
Задача 127. Какое количество теплоты выделится при полном сгорании бензина массой 5 кг; каменного угля массой 10 кг?
Задача 128. Какое количество теплоты выделится при полном сгорании пороха массой 25 г; торфа массой 0,5 т; каменного угля массой 1,5 т?
Задача 129. Сколько теплоты выделится при полном сгорании сухих березовых дров объемом 5 м3?
Задача 130. Сколько теплоты выделится при полном сгорании керосина объемом 0,25 м3; спирта объемом 0,00005 м3; бензина объемом 25 л; нефти объемом 250 л?
Задача 131. На сколько больше теплоты выделится при полном сгорании бензина массой 2 кг, чем сухих березовых дров той же массы?
Задача 132. Во сколько раз больше выделится теплоты при полном сгорании водорода массой 1 кг, чем при полном сгорании сухих березовых дров той же массы?
Задача 133. Смешали бензин массой 2 кг и спирт массой 3 кг. Какое количество теплоты выделится при полном сгорании полученного топлива?
Задача 134. Смешали бензин объемом 1,5 л и спирт объемом 0,5 л. Какое количество теплоты выделится при полном сгорании этого топлива?
Задача 135. В печи сгорели сухие сосновые дрова объемом 0,01 м3 и торф массой 5 кг. Сколько теплоты выделилось в печи?
Задача 136. К зиме заготовили сухие сосновые дрова объемом 2 м3 и каменный уголь массой 1,5 т. Сколько теплоты выделится в печи при полном сгорании в ней заготовленного топлива?
К зиме заготовили сухие сосновые дрова объемом 2 м3 и каменный уголь массой 1,5 т. Сколько теплоты выделится в печи при полном сгорании в ней заготовленного топлива?
Задача 137. При полном сгорании тротила массой 10 кг выделяется
Дж энергии. Чему равна удельная теплота сгорания тротила?Задача 138. При сгорании пороха массой 3 кг выделилось 11400 кДж энергии. Вычислите удельную теплоту сгорания пороха.
Задача 139. Сколько надо сжечь каменного угля, чтобы выделилось
Дж энергии? Дж энергии?Задача 140. В топке котла парового двигателя сожгли торф массой 20 т. Какой массой каменного угля можно было бы заменить сгоревший торф (удельную теплоту сгорания торфа принять равной
Дж/кг)?Задача 141. Сколько каменного угля нужно сжечь, чтобы получить столько же энергии, сколько ее выделяется при сгорания бензина объемом 6 м3?
Задача 142. Сколько спирта надо сжечь, чтобы изменить температуру воды массой 2 кг от 14 до 50
, если вся теплота, выделенная спиртом, пойдет на нагревание воды?Задача 143. Сколько воды, взятой при температуре 14
, можно нагреть до 50 , сжигая спирт массой 30 г и считая, что вся выделяемая при горении спирта энергия идет на нагревание воды?Задача 144. На сколько изменится температура воды объемом 100 л, если считать, что вся теплота, выделяемая при сгорании древесного угля массой 0,5, пойдет на нагревание воды?
Задача 145. На сколько изменится температура воды, масса которой 22 кг, если ей передать всю энергию, выделившуюся при сгорании керосина массой 10 г?
Задача 146. В чем заключается процесс сгорания топлива? В чем разница между сгоранием (нефти, угля) и взрывом (пороха, гремучего газа)?
Задача 147. Определить КПД примуса, зная, что при сжигании 300 г керосина можно вскипятить 15 л воды, взятой при 10
.Задача 148. На спиртовке нагрели 224 г воды от 15
до 75 и сожгли при этом 5 г спирта. Определить КПД спиртовки. Проведите подобный опыт.
Определить КПД спиртовки. Проведите подобный опыт.Задача 149. Каков КПД кузнечного горна, если для нагревания 2 кг стали на 1000
расходуется 0,6 кг кокса?Задача 150. На нагревание 2 л воды от 5 до 100
затрачено 0,1 м3 природного газа. Определить КПД горелки.Задача 151. Чтобы нагреть 1,8 кг воды от 18
до кипения на горелке с КПД 25% потребовалось 92 г горючего. Какова удельная теплота сгорания горючего?Задача 152. Определить КПД нагревателя, в котором израсходовано 80 г керосина для нагревания 3 л воды на 90
.Задача 153. Какое количество воды можно нагреть от 15
до кипения на горелке с КПД 40%, если сжечь 100 л природного газа?Задача 154. Сколько времени потребуется, чтобы нагреть 1,55 л воды от 20 до 100
, если горелка потребляет 0,3 кг спирта в час, а КПД ее 24%?Задача 155. На спиртовке нагревали воду массой 100 г от 16
до 71 . При этом был сожжен спирт массой 10 г. Найти КПД установки.Задача 156. Для нагревания воды объемом 2 л, находящейся в алюминиевой кастрюле массой 400 г, от 15
до 75 был израсходован газ массой 30 г. Определить КПД газовой плиты, считая теплоту, израсходованную на нагревание сосуда, полезной. Как изменится результат, если полезной считать только теплоту, израсходованную на нагревание воды?Задача 157. Каково отношение масс спирта и бензина, если удельная теплота сгорания этих горючих веществ оказалась равной
Дж/кг? Удельная теплота сгорания спирта Дж/кг и бензина Дж/кг.Глава 2.
Изменение агрегатных состояний вещества.
§1. Основные понятия и законы.
1. Фазой называется физически однородная часть вещества, отделенная от остальных частей системы границей раздела (например лед, вода, пар и т.п.). Плавление твердого тела, отвердевание жидкости, испарение и конденсация пара представляют собой примеры фазового перехода. Переход из одной фазы в другую при заданном давлении происходит при строго заданной температуре.
Переход из одной фазы в другую при заданном давлении происходит при строго заданной температуре.
2. Плавлением называется переход из твердой фазы в жидкую. Обратный переход из жидкой фазы в твердую называется отвердеванием или кристаллизацией.
3. При постоянном давлении тело плавится и отвердевает при определенной температуре, которая называется точкой плавления или температурой плавления.
4. Для плавления необходимо передать телу некоторое количество теплоты. За счет этой теплоты потенциальная энергия атомов вещества, имеющего массу m, возрастает на величину
— удельная теплота плавления – количество теплоты, необходимое для плавления единицы массы твердого кристаллического вещества при температуре плавления и постоянном давлении.
При кристаллизации потенциальная энергия молекул уменьшается на такую же величину и соответствующее количество теплоты отводится к окружающим телам.
40. Удельная теплота сгорания топлива
1033. Какие дрова — березовые, сосновые или осиновые — при полном сгорании выделяют больше теплоты, если все они одинаково высушены и массы их равны? (Удельная теплота сгорания осины около 1,3 • 107 Дж/кг.)
Удельная теплота всех этих дров одинакова, поэтому при их сгорании выделится одинаковое количество теплоты.
1034. Можно ли рассчитать, какое количество теплоты выделится при полном сгорании соснового полена? Если можно, то как это сделать, что необходимо знать?
Можно. Для этого надо знать удельную теплоту сгорания и массу полена.
1035. Вычислите, сколько энергии выделится при полном сгорании древесного угля массой 15 кг; керосина массой 200 г.
1036. Какое количество теплоты выделится при полном сгорании бензина массой 5 кг; каменного угля массой 10 кг?
1037. Какое количество теплоты выделится при полном сгорании пороха массой 25 г; торфа массой 0,5 т; каменного угля массой 1,5 т?
1038. Сколько теплоты выделится при полном сгорании сухих березовых дров объемом 5 м3?
Сколько теплоты выделится при полном сгорании сухих березовых дров объемом 5 м3?
1039. Сколько теплоты выделится при полном сгорании керосина объемом 0,25 м3; спирта объемом 0,00005 м3; бензина объемом 25 л; нефти объемом 250 л?
1040. На сколько больше теплоты выделится при полном сгорании бензина массой 2 кг, чем при сгорании сухих березовых дров той же массы?
1041. Во сколько раз больше выделится теплоты при полном сгорании водорода массой 1 кг, чем при полном сгорании сухих березовых дров той же массы?
1042. Смешали бензин массой 2 кг и керосин массой 3 кг. Какое количество теплоты выделится при полном сгорании полученного топлива?
1043. Смешали бензин объемом 1,5 л и спирт объемом 0,5 л. Какое количество теплоты выделится при полном сгорании этого топлива?
1044. В печи сгорели сухие сосновые дрова объемом 0,01 м3 и торф массой 5 кг. Сколько теплоты выделилось в печи?
1045. К зиме заготовили сухие сосновые дрова объемом 2 м3 и каменный уголь массой 1,5 т. Сколько теплоты выделится в печи при полном сгорании в ней заготовленного топлива?
1046. а) При полном сгорании антрацита (твердое топливо) массой 10 кг выделяется 2,9 • 107 Дж энергии. Чему равна удельная теплота сгорания антрацита?
б) В лифте высотного здания Московского университета студент поднялся со спортивным грузом (4 спортивных молота). На какую высоту был поднят груз, если его потенциальная энергия относительно пола первого этажа здания стала эквивалентна энергии, выделяемой при полном сгорании 1 г нефти? (Сведения о грузе смотри в таблице 17.)
1047. На какой высоте над поверхностью океана летела в самолете команда футболистов в то время, когда потенциальная энергия их футбольного мяча в самолете была эквивалентна количеству теплоты, которая выделяется при полном сгорании 1 г нефти? (О мяче смотри таблицу 17.)
1048. Сколько нужно сжечь каменного угля, чтобы выделилось 1,5 • 108 Дж энергии; 1,8 • 105 кДж энергии?
1049. В топке котла парового двигателя сожгли торф массой 20 т. Какой массой каменного угля можно было бы заменить сгоревший торф? (Удельную теплоту сгорания торфа принять равной 1,5 • 107 Дж/кг.)
В топке котла парового двигателя сожгли торф массой 20 т. Какой массой каменного угля можно было бы заменить сгоревший торф? (Удельную теплоту сгорания торфа принять равной 1,5 • 107 Дж/кг.)
1050. Сколько каменного угля нужно сжечь, чтобы получить столько же энергии, сколько ее выделяется при сгорании бензина объемом 6 м3?
1051. Сколько спирта надо сжечь, чтобы изменить температуру воды массой 2 кг от 14 до 50 °С, если вся теплота, выделенная при горении спирта, пойдет на нагревание воды?
1052. Сколько воды, взятой при температуре 14 °С, можно нагреть до 50 °С, сжигая спирт массой 30 г и считая, что вся выделяемая при горении спирта энергия идет на нагревание воды?
1053. На сколько изменится температура воды объемом 100 л, если считать, что вся теплота, выделяемая при сжигании древесного угля массой 0,5 кг, пойдет на нагревание воды?
1054. На сколько изменится температура воды, масса которой 22 кг, если ей передать всю энергию, выделившуюся при сгорании керосина, масса которого равна 10 г?
Кокшетауского технического института Министерства по чрезвычайным ситуациям Республики Казахстан
В 1973 году в город Кокчетав из города Алма-Аты был передислоцирован учебный отряд военизированной пожарной охраны Управления пожарной охраны Министерства внутренних дел Казахской ССР. Учебное подразделение расположилось в бывших казармах военизированной охраны железной дороги станции Кокчетав в пристанционном поселке.В отряде проходили подготовку, переподготовку и повышали квалификацию работники пожарной охраны различных категорий со всех концов республики. Штат аттестованного состава состоял из начальника, заместителя начальника по учебной части, старшего преподавателя, рядовых преподавателей и трех курсовых командиров.
В 1977 году учебное подразделение переехало в новое здание в центре города Кокчетава. Оно состояло из 3-этажного административного корпуса и примыкающего к нему одноэтажного учебного корпуса. Приходилось постоянно совершенствовать учебно-материальную базу отряда.
Приходилось постоянно совершенствовать учебно-материальную базу отряда.
В связи с военизированием пожарной охраны в республике в те годы осложнилась обстановка с кадрами. Руководство МВД Казахской ССР приняло решение о создании 11-месячных курсов по подготовке младшего начсостава пожарной охраны на базе подразделения. В связи с этим учебный центр ВПО МВД Казахской ССР был переименован в школу подготовки и переподготовки младшего и среднего начсостава пожарной охраны МВД Казахской ССР. Но существующая учебно-материальная база не позволяла проводить качественное обучение курсантов, не хватало учебных кабинетов и общежитий. После ходатайства руководству МВД Казахской ССР в 1980 году были выделены финансовые средства на строительство 4-этажного учебно-производственного корпуса со спортзалом, гаражом и учебной башней. Было реконструировано здание столовой, в котором прежде было всего 50 посадочных мест, а после реконструкции стало 150. Тогда же произошло расширение штатов командно-преподавательского состава. Прибыли молодые выпускники Алма-Атинского пожарно-технического училища МВД Казахской ССР. Они активно включились в работу по созданию и укреплению материальной базы, обучению и воспитанию курсантов, что позволило в короткие сроки достичь конкретных результатов.
Заметно улучшилась спортивно-массовая работа. Спортивные команды школы неоднократно выступали на республиканских соревнованиях, на областных состязаниях и турнирах по линии общества «Динамо» и завоевывали призовые места и кубки.
Коллектив был сплоченным, какие бы ситуации не складывались, люди достойно и по-деловому выполняли порученные задания.
Курсанты и слушатели подразделения принимали участие вместе с составом гарнизона в тушении пожаров, оказании помощи городу в благоустройстве, ликвидации паводков в весеннее время, охране общественного порядка и так далее. Благодаря этому подразделение неоднократно поощрялось руководством города ценными подарками, сотрудникам школы даже выделяли квартиры.
Приказом Главного Управления пожарной охраны МВД СССР в учебном подразделении осуществлялась подготовка работников пожарной охраны Таджикской ССР, Туркменской ССР и Киргизской ССР.
Удельная теплота плавления свинца 2,5*104Дж/кг. 3. Какое количество теплоты потребуется для нагревания 20 литров воды от 20 до 42оС в чугунной кастрюле массой 15 кг? 3. Какое количество теплоты необходимо затратить для превращения льда массой 5 кг в
Контрольная работа №1по теме «Тепловые явления»
Вариант №1
1. Определите количество теплоты, необходимое для нагревания чугунного радиатора водяного отопления массой 65 кг от 20 до 42оС. Удельная теплоемкость чугуна 460 Дж/кг оС.
2. При сгорании спирта выделилось 5,4 МДж теплоты. Определите массу сгоревшего спирта, если его удельная теплота сгорания равна 27 МДж/кг.
3. Стальную болванку массой 150 г, раскаленную до 650оС,опускают для закалки в сосуд, содержащий 800 г воды при температуре 15оС. Какова удельная теплоемкость стали, если вода нагрелась до 28оС? Удельная теплоемкость воды 4200 Дж/(кг оС).
4. Определите КПД примуса, если для нагревания 2 кг воды от 10 до 100оС в нем сожгли 40 г керосина. Удельная теплоемкость воды 4200 Дж/(кг оС), а удельная теплота сгорания топливо 46 МДж/кг.
Вариант №2
1. Какое количество теплоты потребуется для того, чтобы нагреть на 40оС медный цилиндр массой 0,5 кг. Удельная теплоемкость меди 400 Дж/кг оС.
2. При сгорании спирта выделилось 2,7 МДж теплоты. Определите массу сгоревшего спирта, если его удельная теплота сгорания равна 27 МДж/кг.
3. Стальное сверло массой 42 г при остывании от 140 до 40 оС выделяет столько же теплоты, сколько необходимо для нагревания воды массой 92 г от 35 до 40 оС. Определите удельную теплоемкость стали. Удельная теплоемкость воды 4200 Дж/(кг оС).
4. Определите КПД керосинки, если для нагревания 3 кг воды от 20 до 100оС в нем сожгли 35 г керосина. Удельная теплоемкость воды 4200 Дж/(кг оС), а удельная теплота сгорания топливо 46 МДж/кг.

Контрольная работа №2 по теме «Изменения агрегатного состояния вещества».
Вариант №1
1.Какое количество теплоты выделится при конденсации водяного пара массой 2,5кг, имеющего температуру 100оС? Удельная теплота парообразования воды 2,3 МДж/кг.
2. Какое количество теплоты необходимо для того, чтобы расплавить кусок свинца массой 0,5кг взятого при температуре плавления? Удельная теплота плавления свинца 2,5*104Дж/кг.
3. Какое количество теплоты потребуется для нагревания 20 литров воды от 20 до 42оС в чугунной кастрюле массой 15 кг? Удельная теплоемкость чугуна 460 Дж/(кг оС), Удельная теплоемкость воды 4200 Дж/(кг оС), плотность воды 1000 кг/м3.
4. Автомобиль на пути 36 км, развивал силу тяги 760 Н. Какая масса бензина, удельной теплотой сгорания 44 МДж/кг, сгорает при движении автомобиля? КПД двигателя автомобиля 22%.
Вариант №2
1. Какое количество теплоты выделится при кристаллизации 0,5кг цинка, взятого при температуре плавления ? Удельная теплота плавления цинка 120кДж/кг.
3. Какое количество теплоты необходимо затратить для превращения льда массой 5 кг в воду температурой 0оС, если начальная температура льда –10°С? Удельная теплоемкость льда 2100 Дж/(кг оС), удельная теплота плавления льда 3,4.10-5 Дж/кг.
4. Какую массу воды можно нагреть от 10 до 100оС на примусе, если в нем сожгли 40 г керосина? КПД примуса 50%, удельная теплоемкость воды 4200 Дж/(кг оС), а удельная теплота сгорания топливо 46 МДж/кг.
Контрольная работа №3 по теме «Электрические явления»
Вариант №1
1. Вычислите сопротивление елочной гирлянды, состоящей из 20 ламп, соединенных последовательно, если каждая из них имеет сопротивление 12 Ом.
2. Какое количество теплоты выделится за 5 с в проводнике сопротивлением 25 Ом, если сила тока в цепи 2 А?
 Две электрические лампы сопротивлением 250 Ом и 190 Ом включены последовательно в сеть с напряжением 220 В. Вычислите силу тока в каждой лампе и падение напряжения на каждой лампе?
Две электрические лампы сопротивлением 250 Ом и 190 Ом включены последовательно в сеть с напряжением 220 В. Вычислите силу тока в каждой лампе и падение напряжения на каждой лампе?4.Сколько времени потребуется для нагревания 2 литров воды, взятой при температуре 20 градусов, можно нагреть до температуры кипения при помощи кипятильника сопротивлением 48 Ом? Напряжение сети 127 В. (Удельная теплоемкость воды 4200 Дж/кг*град.. Плотность воды 1000 кг/м3.)
Вариант №2
1. Два резистора сопротивлением 3 Ом и 6 Ом соединены параллельно. Чему равно их общее сопротивление?
2. Электроплитка включена в сеть с напряжением 220 В работает 2 часа при этом ток в спирали электроплитки равен 3 А. Какую работу совершает электрический ток в спирали электроплитки?
3. Две лампочки сопротивлением 110 Ом и 55 Ом включены параллельно в сеть с напряжением 110 В. Вычислить силу тока в каждой лампочке и общую силу тока в цепи.
4. На сколько градусов нагреется 2 литра трансформаторного масла, взятого при температуре 10о С, при помощи нагревателя мощностью 800 Вт за 10 минут? Удельная теплоемкость масла 2400 Дж/кг*град. Плотность масла 800 кг/м3.
Контрольная работа №4 по теме «Световые явления»
Вариант №1
1. При каком условии тело даёт на экране резкую тень без полутени? Ответ поясните чертежом.
2. Девочка приближается к плоскому зеркалу со скоростью 0,25 м/с. С какой скоростью она сближается со своим изображением?
3. Почему, оценивая на глаз глубину водоёма, мы всегда ошибаемся: глубина кажется меньшей, чем в действительности? Ответ поясните рисунком.
4. Предмет помещён на расстоянии 40 см от тонкой линзы, оптическая сила которой равна 4 дптр. Какое и где получится изображение предмета? Чему равно фокусное расстояние линзы? Сделайте чертёж. Для устранения какого дефекта зрения может быть использована эта линза?
Вариант №2
1.
 Почему тень от ног человека на дороге более четкая, чем тень головы? Ответ обоснуйте.
Почему тень от ног человека на дороге более четкая, чем тень головы? Ответ обоснуйте.2. Девочка стоит перед плоским зеркалом. Как изменится расстояние между девочкой и ее изображением в зеркале, если она отступит от зеркала на 1 м? Ответ пояснить рисунком.
3. Как нужно нацелиться в предмет, находящийся под водой, чтобы попасть в него – выше или ниже предмета? Ответ поясните чертежом.
4. Предмет помещён на расстоянии 60 см от тонкой линзы, оптическая сила которой равна – 2 дптр. Какое и где получится изображение предмета? Чему равно фокусное расстояние линзы? Сделайте чертёж. Для устранения какого дефекта зрения может быть использована эта линза?
5. Внутри светофора стоит обыкновенная лампочка, дающая белый свет. Почему мы видим во время работы светофора, что загораются красный, желтый и зеленый сигналы?
Итоговая контрольная работа
Итоговая контрольная работа.
1 вариант
Итоговая контрольная работа за 8 клаассИтоговая контрольная работа
Цель: Итоговый контроль знаний и умений.Дата проведения: 8а: 8б:
1.Напряжение на зажимах электрического утюга 220 В, сопротивление нагревательного элемента утюга 50 Ом. Чему равна сила тока в нагревательном элементе?
2.Сила тока в железном проводнике длиной 15 см и площадью поперечного сечения 0,02 мм2 равна 250 мА. Каково напряжение на концах проводника? Удельное сопротивление железа 0,1 Оммм2/м.
F
2F
3.Постройте изображение, даваемое собирающей линзой в случае показанном на рисунке. Опишите свойства изображения.
4.Найдите силу гравитационного притяжения двух соприкасающихся свинцовых шаров диаметром 1 м и массой 100 кг каждый.
II вариант.1.В электрической цепи через поперечное сечение проводника за 2 с проходит заряд 20 Кл. Определите силу тока в этом участке.
2.К сети напряжением 120 В параллельно подключены две электрические лампы сопротивлением 200 Ом каждая.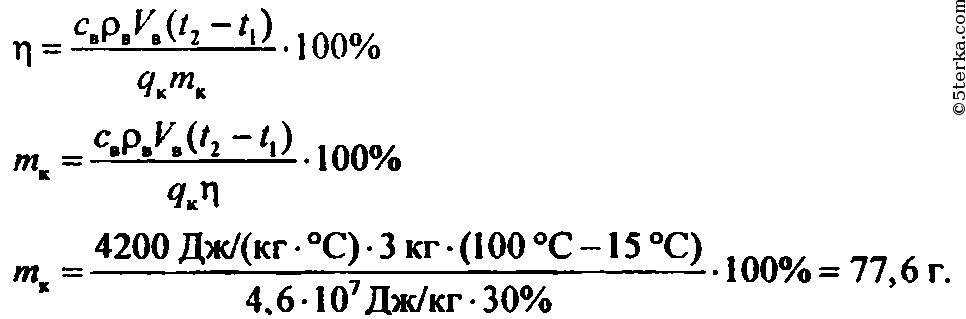 Чему равно их общее сопротивление, общая сила тока, а также сила тока в каждой лампе?
Чему равно их общее сопротивление, общая сила тока, а также сила тока в каждой лампе?
3.Электроплитка рассчитана на напряжение 220 В и силу тока 3 А. Определите мощность тока в электроплитке.
4.Фокусное расстояние линзы 10 см. Чему равна оптическая сила этой линзы?
5.Постройте изображение, даваемое собирающей линзой в случае, показанном на рисунке. Опишите свойства изображения.
2F
F
Приложенные файлы
- 15452642
Размер файла: 23 kB Загрузок: 0
ОТВЕТОВ НА ДОМАШНЕЕ ЗАДАНИЕ №1 — ВСЕ
I.1) Эта проблема то же самое, что и проблема «Ураган Джорджес», с небольшим немного добавлено.
Ключом к решению этой проблемы является знание того, что:
1) 1 мл = 1 кубический сантиметр
2) 1 км = 1000 м = 100000 см
3) 1 м 2 = 10000 см2
Выделенная энергия = 2,46 кДж / мл x объем (мл) воды
объем — это площадь, умноженная на глубину осадков —
Энергия = (2.46 кДж / мл) x [10 км x (10 5 см / км)] 2 х (2 см)
Тонны тротила = (4,92×10 12 кДж) / (4,18×10 6 кДж / тоннуTNT)
I.4) Кислород построил в атмосферу из-за захоронения более миллионов органических веществ лет. Так будем ли мы потреблять весь кислород, если будем сжигать ископаемое топливо? образовались из этой похороненной органики?
Количество O2, потребляемого при сжигании ископаемого топлива:
5.3×10 19 кДж x [(1 моль O 2 ) / 335 кДж] = 1,6×10 17 моль O 2 израсходовано.
Для количества кислорода в атмосфере:
i) площадь поверхности = 4¼r 2 = 4 x x (6,4×10 6 м) 2 x (10000 см 2 / м 2 ) = 5,1×10 18 см 2
ii) граммы O 2 = (5,1×10 18 см2)
x (1000 г / см 2 ) x 0. 22 = 1,1×10 21 г
22 = 1,1×10 21 г
iii) моль O 2 = (1,1×10 21 г) x (1 моль / 32 г) = 3,5×10 19 моль
Вы должны подсчитать, что только около 0,46% (= 1,6×10 17 / 3,5×10 19 ) атмосферного кислород будет израсходован.
I.5) Метан — CH 4 , а пропан — C 3 H 8
МЕТАН: CH 4 + 2O 2 = CO 2 + 2H 2 O
Полученная чистая энергия = (2 C = O + 4 O-H) — (4 C-H + 2 O = O) кДж
получить энергии связи из таблицы 1.3 ->
и так как только один моль CO 2 образуется на сгорело моль топлива, при сжигании метана выделится 810 кДж / моль выделенного CO 2 .
Молярная масса метана составляет 16 г / моль, поэтому при сжигании метана выделит (810 кДж / моль) / (16 г / моль) = около 51 кДж / г сожженного топлива.
ПРОПАН: C 3 H 8 + 5O 2 = 3CO 2 + 4H 2 O
Полученная чистая энергия = (6 C = O + 8 O-H) — (2 C-C + 8 C-H + 5 O = O)
, т. К. Три моля CO. 2 для каждого моль C 3 H 8 сгорела, при горении пропан выделится 677 кДж / моль CO 2 выделено .
Молярная масса пропана составляет 44 г / моль, поэтому при сжигании пропана выделит (2030 кДж / моль) / (44 г / моль) = около 46 кДж / г сожженного топлива.
| СН 4 | С 3 В 8 | |
| кДж на моль
Произведено СО2 | 810 | 677 |
| кДж на грамм
Израсходовано топлива | 51 | 46 |
И.6)
(1,50 доллара за галлон) x (1 галлон / 5,51 фунта) x (1 фунт / 19000 британских тепловых единиц) = 1,43 x 10 -5 британских тепловых единиц
британских тепловых единицстоимость кВтч составляет:
$ 1,43×10 -5 / BTU x (3,97×10 -3 BTU / 1,16×10 -6 кВтч) = 0,049 доллара США / кВтч, что почти равно
предполагаемая стоимость электроэнергии 0,050 $ / кВтч. Убедитесь, что вы прочитали класс
noteboard за интересный комментарий о том, как решается эта проблема
для округа Ориндж.
Убедитесь, что вы прочитали класс
noteboard за интересный комментарий о том, как решается эта проблема
для округа Ориндж.
б) С номерами, указанными в задаче, электромобили будет в 2-4 раза экономичнее бензиновых.Один интересный Вопрос для рассмотрения: откуда электричество для электромобилей? родом из? Что, если он исходит от угольной электростанции с КПД? 33%?
I.16) Эта проблема представляет собой сравнение использования солнечной энергии и масла для нагрева воды в твой дом.
а) требуется 1 калория (0,00419 кДж) для нагрева 1 г (1 мл) воды на 1 ° C, поэтому нагрейте 1 мл воды с 15 ° C до 55 ° C. градусов C требуется:
Водонагреватель будет нагревать 600 литров воды. в день (= 600000 мл), требуется
600 000 мл x 0.168 кДж / мл = 1.0×10 5 кДж
Площадь солнечного коллектора, необходимая для передачи такого количества тепло (при КПД 30%):
площадь = необходимое количество тепла / (солнечное тепло на единицу площади x 0,3)
= (1,0×10 5 кДж) / (1,53 кДж / см 2 x 0,3) = 217 865 см 2 = 21,8 м 2
б) при стоимости коллектора 375 $ / м 2 ,
c) Энергия, необходимая для нагрева воды в течение 20 лет:
и количество масла, необходимое для обеспечения этой энергии при эффективности 90%:
и стоимость = 3.23×10 4 литров x (0,75 доллара США за литр) = 24 000 долларов США для чистой экономии 15 825 долларов США
I.17)
а) При удельной мощности 500 Вт / м 2 ,
энергии, произведенной в год / м2 = 0,5 кВт / м 2 x 24 часа в сутки x 365 дней в году = 4380 кВтч / м 2 в год
площадь, покрытая турбиной = ¼r 2 где r = 25 м, поэтому площадь = 1 963,5 м 2
при КПД 25%, электрическая энергия на турбину =
1,963. 5 м 2 x (4,380 кВтч / м 2 в год) x 0,25 = 2,15×10 6 кВтч в год
5 м 2 x (4,380 кВтч / м 2 в год) x 0,25 = 2,15×10 6 кВтч в год
b) Площадь суши, покрытая ветропарками = (7 827 989 км2) x 0,012 = 93 936 км2
выработки электроэнергии на км 2 = 8 турбин / км 2 x (2,15×10 6 кВтч / год на турбину) = 1,72×10 7 кВтч / км 2 в год
общий потенциал энергии ветра = (1,72×10 7 кВтч / км 2 в год) x 93936 км 2 = 1.62×10 12 кВтч / год
Производство электроэнергии в США в 1990 году составило 2745 ТВтч. = 2,745×10 12 кВтч,
, поэтому общий потенциал энергии ветра составляет 1,62×10 12 кВтч / 2,745×10 12 кВтч x 100% = 59% 1990 Производство электроэнергии в США.
c) При плотности энергии 300 Вт / м 2 :
выработанной энергии = 0,3 кВт / м2 x 24 часа в день x 365 дней в году = 2628 кВтч / м2 в год.
Следуя тем же расчетам, что и выше, все еще используя КПД 25% и 8 турбин на квадратный километр, но при условии, что ветер мощность могла быть собрана на 21% земли США, и эта 1/3 из них была покрытые ветряными фермами, вы должны обнаружить, что 205% потребления электроэнергии в США может быть удовлетворено за счет энергии ветра. Это минимум, так как в некоторых местах ветер будет сильнее.
Глава 11: Горение (Обновлено 31.05.10)
Глава 11: Горение (Обновлено 31.05.10) Глава 11: Сжигание
(Спасибо
к Дэвид
Bayless за письменную помощь.
этот раздел)
Введение — До этого
точка тепла Q во всех задачах и примерах была либо заданной
значение или было получено из отношения Первого закона.Однако в различных
тепловые двигатели, газовые турбины и паровые электростанции тепло
полученные в процессе сгорания с использованием твердого топлива (например,
уголь или дрова). жидкое топливо (например, бензин, керосин или дизельное топливо),
или газообразное топливо (например, природный газ или пропан).
В этой главе мы познакомимся с химией и термодинамика горения типовых углеводородных топлив — (C x H y ), в котором окислителем является кислород, содержащийся в атмосферном воздухе. Обратите внимание, что мы не будем рассматривать сжигание твердого топлива или сложные смеси и смеси углеводородов, входящих в состав бензин, керосин или дизельное топливо.
Атмосферный воздух содержит примерно 21% кислорода (O 2 ) по объему. Остальные 79% «прочих газов» в основном азот (N 2 ), т. предположим, что воздух на 21% состоит из кислорода и на 79% азота. объем. Таким образом, каждый моль кислорода, необходимый для окисления углеводорода, равен сопровождается 79/21 = 3,76 моля азота. Используя эту комбинацию молекулярная масса воздуха становится 29 [кг / кмоль]. Обратите внимание, что это предполагается, что азот обычно не подвергается каким-либо химическим воздействиям. реакция.
Процесс горения — Основной процесс сгорания можно описать с помощью топлива ( углеводород) плюс окислитель (воздух или кислород), называемый Реагенты , которые подвергаются химическому процессу, выделяя тепло, чтобы сформировать Продукты горения таким образом, чтобы масса сохранялась. в простейший процесс сгорания, известный как стехиометрический Сгорание , весь углерод в топливе образует диоксид углерода (CO 2 ) и весь водород образует воду (H 2 O) в продуктах, поэтому мы можем записать химическую реакцию следующим образом:
где z известен как стехиометрический коэффициент для окислителя (воздуха)
Обратите внимание, что эта реакция дает пять неизвестных: z, a,
b, c, d, поэтому нам нужно решить пять уравнений.Стехиометрический
горение предполагает отсутствие в продуктах избыточного кислорода, поэтому
d = 0. Остальные четыре уравнения мы получаем в результате уравновешивания числа
атомов каждого элемента в реагентах (углерод, водород, кислород
и азота) с числом атомов этих элементов в
товары. Это означает, что никакие атомы не разрушаются и не теряются в
реакция горения.
Это означает, что никакие атомы не разрушаются и не теряются в
реакция горения.
Элемент | Количество в реактивах | = | Количество товаров | Сокращенное уравнение |
Углерод (C) | х | а | а = х | |
Водород (H) | л | 2б | b = y / 2 | |
Кислород (O) | 2z | 2a + b | г = а + Ь / 2 | |
Азот (N) | 2 (3.76) z | 2c | c = 3,76z |
Обратите внимание, что образующаяся вода может находиться в паре или жидкая фаза, в зависимости от температуры и давления продукты сгорания.
В качестве примера рассмотрим стехиометрическое горение метана (CH 4 ) в атмосферном воздухе. Приравнивание моляра коэффициенты реагентов и продуктов получаем:
Теоретическое соотношение воздух и воздух-топливо -The
минимальное количество воздуха, которое позволит полностью сгорать
топливо называется Теоретическая
Air (также именуемый Стехиометрический воздух ). В этом случае продукты не содержат кислорода. Если мы поставляем
меньше теоретического воздуха, тогда продукты могут содержать углерод
монооксида (CO), поэтому обычной практикой является подача более
теоретический воздух, чтобы предотвратить это явление. Это превышение Воздух приведет к появлению кислорода в
продукты.
В этом случае продукты не содержат кислорода. Если мы поставляем
меньше теоретического воздуха, тогда продукты могут содержать углерод
монооксида (CO), поэтому обычной практикой является подача более
теоретический воздух, чтобы предотвратить это явление. Это превышение Воздух приведет к появлению кислорода в
продукты.
Стандартная мера количества воздуха, используемого в процесс сгорания — Air-Fuel Коэффициент (AF), определяемый следующим образом:
Таким образом, учитывая только реагенты метана при сжигании теоретическим воздухом, представленным выше, получаем:
Решенная задача 11.1 — дюйма В этой задаче мы хотим разработать уравнение горения и определить соотношение воздух-топливо для полного сгорания н-бутана (C 4 H 10 ) с а) теоретическим воздухом и б) 50% избытком воздуха.
Анализ продуктов сгорания — Горение всегда происходит при повышенных температурах и мы предполагаем, что все продукты сгорания (включая воду пар) ведут себя как идеальные газы. Поскольку у них другой газ постоянных, удобно использовать уравнение состояния идеального газа в условия универсальной газовой постоянной:
В анализе продуктов сгорания нет представляет ряд интересных объектов:
1) Что такое процентный объем конкретных продуктов, в частности углекислого газа (CO 2 ) и углерода монооксид (CO)?
2) Что такое роса точка водяного пара в продуктах сгорания? Это требует оценка парциального давления паровой составляющей воды продукты.
3) Существуют экспериментальные методы объемного анализ продуктов сгорания, обычно проводится на Dry Базис , дающий процент объема всех компонентов, кроме водяного пара. Это позволяет просто метод определения действительного воздушно-топливного отношения и использованного избыточного воздуха в процессе горения.

Для идеальных газов мы находим, что мольная доля y i i-го компонента в смеси газов при определенном давлении P
а температура T равна объемной доле этого компонента.
Поскольку из молярного отношения идеального газа: P.V = N.R u .T,
у нас:
Кроме того, поскольку сумма объемов компонентов V и должны равняться общему объему V, имеем:
Используя аналогичный подход, определяем частичную давление компонента с использованием закона парциальных давлений Дальтона:
Решенная проблема 11.2 — дюйма эта проблема Пропан (C 3 H 8 ) сжигается с 61% избытком воздуха, который поступает в камеру сгорания при 25 ° С.Предполагая полное сгорание и полное давление 1 атм. (101,32 кПа), определите а) соотношение воздух-топливо [кг-воздух / кг-топливо], б) процентное содержание двуокиси углерода в продуктах, и c) температура точки росы продуктов.
Решенная проблема 11,3 — дюйма эта проблема Этан (C 2 H 6 ) сжигается атмосферным воздухом, и объемный анализ сухие продукты сгорания дает: 10% CO 2 , 1% CO, 3% O 2 и 86% № 2 .Развивать уравнение горения, и определить а) процент превышения воздух, б) соотношение воздух-топливо и в) точка росы при сгорании. товары.
Анализ горения по первому закону — Основная цель горения — выработка тепла за счет изменения энтальпия от реагентов к продуктам. Из Первого Закона уравнение в контрольном объеме без учета кинетической и потенциальной энергии изменений и, если не делать никаких работ, имеем:
, где суммирование ведется по всем продукты (p) и реагенты (r).N означает количество молей каждого компонента, а h [кДж / кмоль] относится к молярной энтальпии каждый компонент.
Поскольку существует ряд различных веществ нам нужно установить общее эталонное состояние для оценки энтальпия, обычно выбирают 25 ° C и 1 атм, что составляет обычно обозначается надстрочным индексом o. Проф. С. Бхаттачарджи из Государственный университет Сан-Диего разработал экспертную систему на базе Интернета в < www.thermofluids.net > позвонил ТЕСТ ( т г E xpert S система для Т гермодинамика) в которую он включил набор таблиц свойств идеального газа, все основанные на по энтальпии h o = 0 по этой общей ссылке.Мы адаптировали некоторые из этих таблиц специально для этого раздела, и их можно найти в следующая ссылка:
Горение Таблицы молярной энтальпии
В качестве примера снова рассмотрим полное сгорание метана (CH 4 ) с теоретическим воздухом:
Обратите внимание, что в реагентах и продуктах В приведенном выше примере у нас есть основные элементы O 2 и N 2 как а также соединения CH 4 , CO 2 и H 2 O.Когда соединение образуется, изменение энтальпии называется изменением энтальпии. Энтальпия формации , обозначенной h f o , и для нашего примера:
Вещество
Формула
hfo [кДж / кмоль]
Двуокись углерода
CO 2 (г)
-393 520
Водяной пар
H 2 O (г)
-241 820
Вода
H 2 O (л)
-285 820
Метан
CH 4 (г)
-74,850
где (г) относится к газу, а (л) относится к жидкость.
Знак минус означает, что процесс Экзотермический , т.е. при образовании соединения выделяется тепло. Обратите внимание, что энтальпия образования основных элементов O 2 и N 2 составляет нуль.
Сначала рассмотрим случай, когда достаточно теплопередача таким образом, чтобы и реагенты, и продукты находились на 25 ° C и давление 1 атм, и что водный продукт является жидким. С нет заметного изменения энтальпии, уравнение энергии становится:
Это тепло (Qcv) называется энтальпией . горения или нагрева Стоимость топлива.Если продукты содержат жидкую воду, тогда она на выше Теплотворная способность (как в нашем примере), однако, если продукт содержит водяной пар, то это нижний предел . Теплотворная способность топлива. В энтальпия сгорания — это наибольшее количество тепла, которое может быть высвобождается заданным топливом.
Температура адиабатического пламени — Противоположная крайность приведенного выше примера, в котором мы оценили энтальпия горения — это случай адиабатического процесса, в котором тепло не выделяется.Это приводит к значительной температуре увеличение количества продуктов сгорания (обозначается адиабатической Температура пламени ), которая может быть уменьшается за счет увеличения воздушно-топливной смеси.
Решенная задача 11.4 — Определить температура адиабатического пламени для полного сгорания Метан (CH 4 ) с 250% теоретического воздуха в адиабатическом контрольном объеме.
Это уравнение может быть решено только итеративным методом.
метод проб и ошибок с использованием таблиц Sensible
Энтальпия против температуры для всех четырех
компоненты продукции — CO 2 ,
H 2 O, O 2 ,
и N 2 .Быстрый
приближение к температуре адиабатического пламени можно получить следующим образом:
при условии, что продукты полностью состоят из воздуха. Такой подход был
представленный нам Potter и Somerton в их Schaum’s
Очерк термодинамики для инженеров ,
в котором они предположили, что все продукты имеют номер N 2 .
Мы считаем, что более удобно использовать воздух, предполагая репрезентативное значение
особого
Теплоемкость воздуха : C p, 1000K = 1,142 [кДж / кг.K].
Такой подход был
представленный нам Potter и Somerton в их Schaum’s
Очерк термодинамики для инженеров ,
в котором они предположили, что все продукты имеют номер N 2 .
Мы считаем, что более удобно использовать воздух, предполагая репрезентативное значение
особого
Теплоемкость воздуха : C p, 1000K = 1,142 [кДж / кг.K].
Таким образом, суммируя все моли произведений, получаем:
Используя таблицы Sensible Энтальпия в зависимости от температуры мы оценили энтальпия всех четырех продуктов при температуре 1280К.Этот в результате общая энтальпия составила 802 410 [кДж / кмоль топлива], что составляет чрезвычайно близко к требуемому значению, что оправдывает такой подход.
Задача 11.5 — — Определите адиабатическую температуру пламени для полное сгорание пропана (C 3 H 8 ) с 250% теоретического воздуха в адиабатическом контрольном объеме [T = 1300 КБ].
______________________________________________________________________________________
Инженерная термодинамика, Израиль
Уриэли под лицензией Creative
Общедоступное авторское право — Некоммерческое использование — Совместное использование 3.0 Соединенные Штаты
Лицензия
Керосин — обзор | Темы ScienceDirect
2.4 Керосин и альтернативные виды топлива
Название керосин обычно применяется к авиационному топливу, сжигаемому в авиационных газотурбинных двигателях, коммерческих или военных, но спецификации керосина могут меняться в зависимости от типа применения. Топливо для использования в военных целях имеет более широкую спецификацию и обозначается буквами JP (реактивное топливо), за которыми следует число от 1 до 10.Гражданские керосины относятся к семействам Jet A или Jet B.
Jet B представляет собой смесь керосина и бензина в соотношении 30–70. Он легче, чем Jet A, и с ним труднее обращаться из-за его высокой воспламеняемости. Он имеет очень низкую температуру замерзания — 60 o C и аналогичен военному JP-4. В гражданской сфере он используется на Аляске, в Северной Канаде и в России в относительно небольших количествах.
Он имеет очень низкую температуру замерзания — 60 o C и аналогичен военному JP-4. В гражданской сфере он используется на Аляске, в Северной Канаде и в России в относительно небольших количествах.
Основным коммерческим сервисным керосином является семейство Jet A. Самым распространенным является Jet A-1 с типичной плотностью 0.804 кг / л, удельная энергия 42,8 МДж / кг, температура вспышки 38 o C и точка замерзания -47 o C. Другой вариант, известный только как Jet A, немного тяжелее с 0,820 кг / л. плотность, практически такая же удельная энергия и температура вспышки, а также более высокая температура замерзания — 40 o C.
Ключевым отличием является температура замерзания. Коммерческие самолеты летают на крейсерских высотах, на которых температура наружного воздуха может достигать -60 o C. По мере того, как дальность полета самолета увеличивается и беспосадочные полеты покрывают все большие расстояния, время, в течение которого крылья самолета находятся при таких очень низких температурах, становится больше и требуется осторожность. следует давать во избежание того, чтобы замороженное топливо заблокировало топливные насосы, подающие керосин к двигателям, и прервало подачу.Джет А температура замерзания оказалась слишком высокой для длительных полетов над Северным полюсом, и его почти полностью заменил Джет А-1. Сегодня он все еще доступен в Соединенных Штатах и некоторых местах в Канаде.
Был проведен высокий уровень исследований и последовавших за ними испытаний, чтобы найти альтернативу керосину. Причины разнообразны: во-первых, нефть — невозобновляемый ресурс, и в будущем она будет закончена в неизвестный срок; во-вторых, наличие альтернативного источника может дать авиакомпаниям выбор и получить больший контроль на рынке топлива, чем зависимость от одного поставщика; и, наконец, альтернативное топливо должно быть более экологичным, а его производственный цикл должен оставлять меньший углеродный след, сокращая местные выбросы и выбросы, связанные с изменением климата.
Найти нужный товар оказывается чрезвычайно сложной. Ключевым элементом является количество изменений, которые может потребоваться новое и другое топливо в системе воздушного транспорта. Конструкция самолетов и аэропортов основана на использовании бензина, керосина или другого топлива с аналогичными химическими и механическими свойствами. Отказ от этого предположения ведет к серьезному обновлению всей логистики (транспортировка, распределение, хранение) и, возможно, новым требованиям к конструкции двигателей и топливных баков.Поскольку архитектура коммерческих самолетов представляет собой очень интегрированную дисциплину, такие изменения предполагают полную реконструкцию самолета в конструкции, отличной от сегодняшней конструкции «труба с крыльями».
Два основных направления исследований в этой области сосредоточены на производстве жидкости, настолько похожей на ископаемый керосин, которую можно смешивать с ним, сохраняя те же свойства. Термин drop-in описывает эти виды топлива. Второй и относительно новый подход — это использование некоторого электрического источника энергии, если не для полной замены керосина, для частичной замены некоторых задач, требующих энергии двигателя в современных самолетах, таких как система кондиционирования воздуха или гидравлические системы. .Вторым шагом будет гибридная концепция, в которой самолет будет использовать керосин на этапах полета с высокой мощностью (взлет, начальный набор высоты) и перейдет на электричество на этапах с низким энергопотреблением, таких как крейсерский полет или заход на посадку.
В обоих приложениях непосредственными преимуществами будут экологические, если жизненный цикл заменяемого топлива оставляет меньший углеродный след, чем ископаемый керосин, или если потребляемая электроэнергия получается возобновляемым способом. Гипотетическое энергетическое преимущество в первом случае сомнительно, потому что самолет потребляет точно такое же количество энергии с такой же эффективностью.Наш нынешний опыт показывает небольшие преимущества в тепловой мощности некоторых протестированных видов биотоплива, но всегда очень незначительные.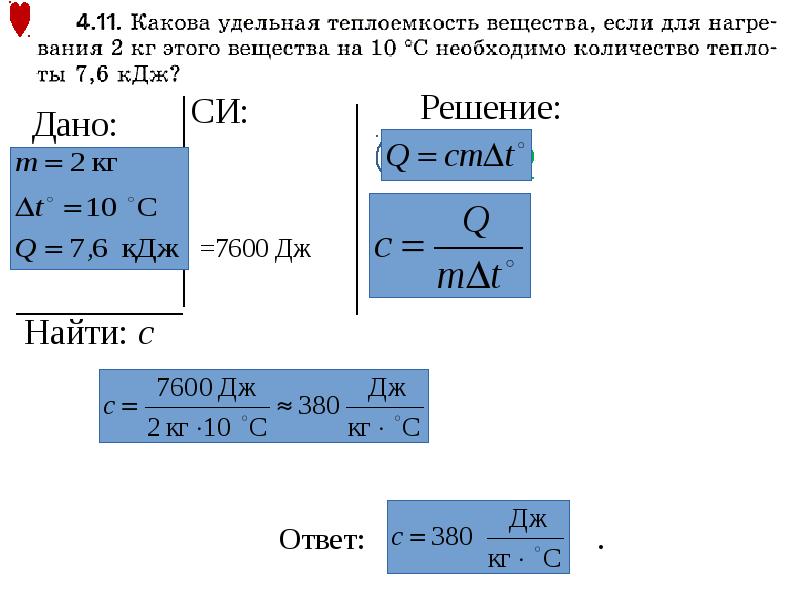
Систематическое использование электроэнергии недостаточно развито, чтобы установить точные цифры. Замена гидравлической и пневматической системы электрическими элементами сократит энергию, извлекаемую из двигателей, и, если это будет лучше, чем энергия, необходимая для транспортировки более крупных батарей, повысится эффективность. Как и во всех случаях сравнения веса и энергии, результат более благоприятен для моделей малой и средней дальности.Прогресс идет медленно, некоторые программы изначально назывались «Все электрические самолеты», а затем перешли на более благоразумное название «Больше электрических самолетов». Некоторые приложения этих технологий уже находятся в коммерческой эксплуатации. Boeing B-787 был введен в эксплуатацию в октябре 2011 года, и в нем использовалось электричество для замены пневматической системы и антиобледенительной системы крыльев. Производитель заявляет, что экономия топлива может возрасти до 3%, что приведет к меньшему расходу и меньшему весу. Некоторые важные технические проблемы с ионно-литиевыми батареями большой мощности во время первоначального обслуживания, по-видимому, указывают на то, что этой технологии все еще требуется некоторое дополнительное время для созревания.
Электродвигатели для замены турбинных двигателей или гибридные двигатели, сочетающие в себе обе двигательные технологии, являются относительно новыми, поскольку соотношение энергии и веса батарей еще не достигло значений, необходимых для двигателей коммерческих самолетов. Некоторые легкие модели летали с разными силовыми установками: в 2008 году Boeing продемонстрировал 770 кг. Максимальная взлетная масса (MTOM), двухместный самолет Diamond, летавший с водородным топливным элементом, заменяющим поршневой двигатель мощностью 80 л.с. В 2014–2017 годах компания Airbus провела испытания двухместного вентилятора MTOM E-Fan массой 550 кг с двумя электродвигателями, питаемыми от литий-ионных аккумуляторов.Ни одна из этих программ не была продолжена, но и Airbus, и Boeing поддерживают дополнительные исследования в отношении гибридного регионального авиалайнера в категории 50–80 мест.
Биокеросин или альтернативное топливо имеют более техническое определение, основанное на многолетнем опыте автомобильной промышленности с этанолом, кукурузой и соевым сырьем. Многие авиакомпании выполняли регулярные рейсы с использованием смеси био- и ископаемого керосина без каких-либо инцидентов. С 2011 года существует сертификация биокеросина (ASTM D7566), а современные двигатели сертифицированы для использования смеси, содержащей до 50% попадающего топлива.
Ключевым моментом является отсутствие экономической жизнеспособности. Стоимость биокеросина может составлять порядка 200–250 долларов США за баррель эквивалента, что в 3 или 4 раза превышает нынешнюю цену ископаемого керосина. Здесь проводится множество исследований лучшего сырья, идущих в сторону маслянистых растений, не конкурирующих с производством продуктов питания, таких как ятрофа или камелина, а затем и микроскопических водорослей. В любом случае масштабы производства невелики, и ожидается, что себестоимость единицы продукции может улучшить что-то при более высоком объеме производства, но вряд ли удастся достичь конкурентной ценовой ситуации на промышленной основе.
Автомобильное топливо содержит обязательный минимальный уровень биокомпонентов. Обоснование состоит в том, что экономия CO 2 на основе жизненного цикла должна иметь цену. Если цена углерода будет включена, аналогичная процедура регулирования может быть применена к биокеросину, чтобы добиться сокращения вклада авиационного сектора в изменение климата. После ратификации Парижского соглашения в ноябре 2015 года, произошедшей год спустя, усиливается давление с целью включения затрат на выбросы углерода в любую экономическую политику, связанную с энергией.
Справочник по керосину — мазут
Объяснение керосинового топлива — простое руководство
В Crown Oil у нас есть давние связи с керосином, начиная с нашего скромного начала, когда наш основатель начал бизнес по продаже масляных ламп от двери до двери в 1928 году. За это время мы накопили обширные знания о керосине, и мы обязаны много изобретения для того, где мы находимся сегодня.
За это время мы накопили обширные знания о керосине, и мы обязаны много изобретения для того, где мы находимся сегодня.
Когда наши клиенты обращаются к нам с вопросами, касающимися керосина, мы всегда готовы ответить на любые вопросы.Чтобы помочь вам лучше понять керосин, мы собрали подробную информацию, которая не поразит вас лишней болтовней о его использовании, целях и законности.
Если у вас есть какие-либо вопросы о керосине и вы хотите обсудить ваши требования, позвоните в нашу дружную и компетентную команду сегодня по телефону 0330 123 1444, чтобы узнать, чем мы можем вам помочь. Мы также можем предоставить вам расценки на основе последних цен на керосин, и вы также можете сделать покупку, позвонив по тому же номеру.
Что такое керосин?
Керосин — прочная легковоспламеняющаяся жидкость, используемая многими предприятиями и домами по всему миру для выработки тепла, света и энергии.Хотя это относится к одному топливу, у него много названий, включая керосин, парафин, топочный мазут, 28 секунд, керо, ламповое масло, горючее масло и котельное топливо.
Термин «28-секундное масло» используется для обозначения вязкости керосина с помощью специального теста, определяющего, как долго 50 мл масла капает в химический стакан. Это также объясняет, почему красный дизель получил свое «35-секундное» название.
Краткая история керосина
В то время как нефть добывалась из сырой нефти на протяжении веков — самые ранние записи о перегонке относятся к 9 – векам — термин «керосин» используется с середины 19 века, когда он был зарегистрирован в качестве товарного знака в США канадским геологом Абрахамом Пинео Геснером в 1854 году в качестве лампового масла, которое было добыто из угля.Однако Абрахам Геснер утверждает, что производство керосина фактически началось немного раньше, в 1846 году, когда он утверждает, что провел публичную демонстрацию в Шарлоттауне, на острове Принца Эдуарда, нового процесса, который он обнаружил.
В 1851 году американский изобретатель Сэмюэл Мартин Киер разработал процесс перегонки сырой нефти и продал полученный дистиллят как «углеродное масло». Благодаря открытию того, как перегонять сырую нефть, Кир стал дедушкой американской нефтяной промышленности.
Исторически керосин добывался из ископаемых видов топлива, таких как уголь, горючие сланцы и древесина. Керосину удалось идти в ногу со временем, чему способствовали те, кто открыл улучшенные методы дистилляции, которые помогли превратить керосин в прочное и надежное топливо, которым он является сегодня.
До изобретения электричества керосин был нашим основным способом обогрева и освещения мира. Но времена быстро изменились, что привело к сокращению использования масляных ламп в более развитых районах и, как правило, ассоциировалось с сельским отоплением.
Его название произошло от κηρός (керос), что по-гречески означает воск — воскообразное вещество первоначально было получено в процессе дистилляции. В 1854 году его название было зарегистрировано в качестве товарного знака Геснером, прежде чем оно превратилось в общее название товарного знака. Первой компанией, которая распределяла керосин среди предприятий и домов, была Kerosene Gas Light Company в 1854 году после того, как Геснер переехал из Канады в Ньютаун-Крик, Лонг-Айленд, Нью-Йорк, чтобы основать свою новую компанию.
Продажа керосина в Большом Манчестере, Великобритания
Несколько лет спустя, в 1928 году, Гарри Гринсмит основал семейный бизнес, который позже стал Crown Oil, продавая керосин от двери до двери жителям Хейвуда в Большом Манчестере (где наша штаб-квартира находится по сей день), вскоре получив прозвище «Лампа Гарри» от местного сообщества.Итак, у нас есть керосин и Гарри, которых нужно поблагодарить за наш огромный успех сегодня! Узнайте больше об истории Crown Oil здесь.
Сегодня Crown Oil поставляет намного больше топлива, масел и смазок по всей Великобритании, но керосин по-прежнему остается одним из самых популярных видов топлива благодаря своей универсальности и горючести. Давайте подробно рассмотрим топливо и все причины, по которым на него полагаются предприятия и дома по всей Великобритании.
Как производится керосин?
Керосин обычно светлый, чистый и не содержит твердых веществ.Обычно он бледный, желтый или бесцветный, но часто в него добавляют краситель, чтобы отличить его от других видов топлива, таких как красное дизельное топливо.
Kero имеет низкую вязкость и плотность 0,78-0,81 г / см³ (грамм на кубический сантиметр). Его фактическая плотность составляет 0,82 г / см³, однако, поскольку парафин составляет 0,8 г / см³, а два масла практически одинаковы, золотая середина находится на уровне 0,81 г / см³.
По химическому составу керосин состоит из смеси углеводородов. Его состав варьируется в зависимости от источника, но обычно содержит около 10 различных углеводородов, каждый из которых содержит 10-16 атомов углерода на молекулу.
Его основными составляющими являются насыщенные парафины с прямой и разветвленной цепью и циклопарафины в форме кольца (нафены).
Керосин добывается из нефти, природного масла, находящегося под поверхностью земли. При высоких температурах от 150 до 275 ° C нефть добывается из-под земли и разбивается на ряд видов топлива в процессе, называемом фракционной перегонкой, включая бензин, мазут, бутан, пропан, смазочное масло и керосин.
Затем извлекается горючая углеводородная жидкость, керосин, в результате чего остается прозрачное жидкое масло, которое затем продается таким дистрибьюторам, как Crown Oil.
Для получения дополнительной информации об этом процессе мы объяснили все о газойле здесь:
Вредны ли пары керосина?
Керосин горит относительно чисто и имеет низкий риск образования оксида углерода, а из-за отсутствия паров топлива он не может взорваться или стать причиной пожара. Однако масло выделяет пары, и вдыхание последующего количества паров керосина может вызвать головокружение, а долгосрочное — вызвать неврологическое повреждение или повреждение почек. Таким образом, хотя керосин безопасен при прикосновении, он токсичен при вдыхании или проглатывании и может быть смертельным.
По данным Всемирной организации здравоохранения (ВОЗ), мазут может вызвать повреждение легких при проглатывании, поэтому, если это произойдет, обратитесь за медицинской помощью.
Безопасно ли использование керосина в помещении?
Проще говоря, да! Керосин — это некоррозионное, менее летучее топливо по сравнению с другими видами топлива, такими как красное дизельное топливо и бензин. Его температура воспламенения составляет 38 ° C по сравнению с бензином, который составляет -40 ° C, что делает его значительно безопасным при хранении и обращении.
Более того, масляные системы отопления не будут выделять грязь, сажу или запахи в помещении при правильной установке и хранении.
Каковы преимущества использования керосина?
Это безопасно — с низким риском отравления угарным газом и чистым ожогом керосин является одним из самых безопасных доступных видов топлива.
Это дешевле, чем газ — он экономичен в производстве и имеет невероятно низкие цены, что делает его одним из самых экономичных способов обогрева дома.
Это экологически чистый продукт — он производит меньше дыма в парафиновой форме по сравнению с углем и древесиной. Однако он может выделять некоторые ядовитые газы, поэтому важно обращаться с ним и хранить его правильно, чтобы избежать вдыхания.
Он имеет длительный срок хранения — он не вызывает коррозии, пока хранится в подходящем резервуаре в сухих и контролируемых условиях.
Использование керосина
Изначально керосин был скромным топливом для масляных ламп, а сегодня он используется в основном в качестве топочного мазута и транспортного топлива, в основном в качестве топлива для реактивных двигателей. Однако во всем мире существует множество изобретательных применений топочного мазута, которые делают его неотъемлемой частью жизни.
Использование керосина зависит от марки топлива.В Великобритании есть две марки керосина, которые соответствуют требованиям британского стандарта BS2869:
. BS 2869 Class C1 — это более легкий дистиллят и может использоваться в фонарях
BS 2869 Class C2 — это более тяжелый дистиллят и используется для бытового печного топлива и коммерческого использования
Дополнительную информацию об этих стандартах топлива см. В нашем руководстве по спецификациям топлива.
Отопление, освещение и приготовление пищи
Исторически керосин использовался в качестве источника света в масляных лампах и фонарях, но это было огромной пожарной опасностью, и в 1880 году почти 2 из каждых 5 пожаров в Нью-Йорке были вызваны неисправными лампами Kero.
Многие туристы и слаборазвитые страны, такие как Нигерия и Индия, до сих пор используют керосин в лампах и жидких печах, где он продается на некоторых заправочных станциях. Амиши, как правило, не пользуются электричеством, поэтому они часто используют керосин для освещения в ночное время.
В Японии керосин используется в качестве топлива для отопления дома для стационарных и переносных обогревателей. Его можно купить на любой заправке или доставить на дом. Сегодня в Англии керосин часто используется в качестве топлива для отопления в отдаленных районах, не подключенных к национальной сети.
Топливо для реактивных двигателей
В последнее время керосин широко используется в качестве авиационного топлива; он менее подвержен замерзанию, не горит слишком быстро при высоких температурах и легко воспламеняется, а это означает, что он идеально подходит для нужд самолета.
Чистящее средство
Керосин можно использовать в качестве чистящей жидкости на велосипедных цепях и ободах для удаления смазки.
Пожарное развлечение
Керосин широко используется в развлечениях артистами цирка, безопасными спецэффектами и танцорами с огнём благодаря своей высокой температуре воспламенения и низкой температуре возгорания.Это гораздо более безопасный вариант, чем другие источники пламени, но при этом впечатляющий эффект.
Его адаптивность делает его одним из самых популярных видов топлива в Crown Oil. По оценкам, около 1,6 млн домохозяйств в Великобритании полагаются на керосин, которые не подключены к электросети, при этом ежедневно по всему миру используется около 1 084 200 баррелей керосина.
Зачем использовать керосин для отопления?
Компания Crown Oil поставляет керосин для предприятий и домов, в основном для отопления и топлива, от 205-литровых бочек до 36 000 литров и более.Жонглеров с огнем тоже можно покупать у ствола — это уже много жонглирования!
Имея несколько альтернатив для обогрева дома и рабочего места, каковы преимущества выбора керосина?
Высокая эффективность — на единицу объема керосина выделяется больше тепла, чем при использовании альтернативных видов топлива, таких как газ или электричество
Доступность — низкие цены на топливо делают его одним из самых дешевых способов обогрева вашего дома или рабочего места
Безопасность — топочный мазут отличается чистым горением с низким уровнем выбросов окиси углерода
Керосин портится?
Керосин, как и большинство видов топлива, не следует оставлять на хранение в течение длительного времени, так как топливо загрязняется водой, и этот испорченный керосин может вызвать повреждение вашего обогревателя.
Мы рекомендуем проверять ваш керосин не реже одного раза в год — и наша команда с радостью вам в этом поможет. Мы также можем помочь с подъемом топлива и его доработкой, среди нашего спектра услуг по охране окружающей среды.
Альтернативы керосину
Существуют подходящие альтернативы сжиганию масла, в зависимости от того, как вы его используете. В качестве реактивного топлива он является предпочтительным топливом.
В качестве топлива для отопления используются более чистые смеси топлива, такие как керосин Kleenburn и керосин премиум-класса, способные обеспечить более чистое отопление в доме.
В целом, если вам нужна замена керосинового обогревателя, лучше всего провести исследование или поговорить с одним из наших экспертов, чтобы узнать, подойдет ли другое топливо.
Почему выбирают Crown Oil для керосина?
Если вы хотите купить керосин, у Crown Oil есть множество вариантов для вашего мазута:
Экологически чистый — с такими опциями, как керосин Kleenburn, керосин премиум-класса и оптовые закупки, Crown Oil прилагает все усилия, чтобы как можно меньше воздействовать на окружающую среду
Бесплатное управление топливом — Никогда не заканчивайте топливо с нашей командой мониторинг вашего использования и предоставление пополнений по мере необходимости
Гибкие условия оплаты для предприятий — позволяющие платить в соответствии с вашим бюджетом и графиком
Покрытие для Великобритании — Crown Oil имеет склады по всей Великобритании, поэтому где бы вы ни находились Вам нужно топливо, мы можем доставить его вам
Стандартная доставка от 24 до 48 часов — избавляет вас от нежелательных простоев.Мы можем доставить топливо в течение нескольких часов благодаря нашей круглосуточной службе экстренной помощи.
Рентабельность — Crown Oil может предложить вам привлекательные цены на керосин благодаря нашей возможности покупать оптом
Если вам нужен надежный поставщик керосина, выберите Crown Oil сегодня. Позвоните нашей дружной команде сегодня, чтобы обсудить ваши требования и узнать, как мы можем вам помочь. Вы также можете запросить расценки и купить керосин, позвонив по тому же номеру.
Содержание энергии в некоторых общих источниках энергии
Содержание энергии в некоторых обычно используемых источниках энергии:
| Источник энергии | Блок | Содержание энергии ( БТЕ ) | ||||
|---|---|---|---|---|---|---|
| Электроэнергия 1 | -час | 3412 | ||||
| Бутан | 1 кубический фут (куб.футов) | 3200 | ||||
| Уголь | 1 тонна | 28000000 | ||||
| Сырая нефть | 1 баррель — 42 галлона | 5800000 | ||||
| Топливо Масло №15 | ||||||
| Мазут № 2 | 1 галлон | 139600 | ||||
| Мазут № 3 | 1 галлон | 141800 | ||||
| Мазут 4 | ||||||
| Мазут №5 | 1 галлон | 148800 | ||||
| Мазут № 6 | 1 галлон | 152400 | ||||
| Дизельное топливо | 1 галлон | 13915 | 9015 9015 | |||
| Природный газ | 1 кубический фут (куб. Фут) | 950 — 1150 | ||||
| Топочный мазут | 1 галлон | 139000 | ||||
| Керосин | ||||||
| 9016 Пеллеты | 1 тонна | 16500000 | ||||
| Пропан СНГ (сжиженный нефтяной газ) | 1 галлон | |||||
| Пропан 60 o F | 1 куб. Фут (куб.футов) | 2550 | ||||
| Остаточное жидкое топливо 1) | 1 бочка — 42 галлона | 6287000 | ||||
| Древесина — воздушная сушка | 1 Шнур | 2001600000 | ||||
| 2001600000 | 1 фунт | 8000 |
1) Остаточное жидкое топливо — жидкая или полужидкая высококипящая фракция остатка от перегонки сырой нефти.
- 1 галлон (U.S.) = 3,785×10 -3 м 3 = 3,785 дм 3 (литр)
- 1 фут 3 = 0,02832 м 3
- 1 баррель (США, нефть) = 1,33 барреля (США, жидкий) = 5,61458 куб.фут = 42 галлона (США, жидкий) = 158,9873 литра
- 1 фунт м = 0,4536 кг
- 1 тонна (короткая) = 2000 фунтов = 907 кг
Btu — британская тепловая единица
Единица тепла в британской системе мер — BTU — составляет
- количество тепла, необходимое для повышения температуры одного фунта воды до 1 o F ( 58.5 o F — 59,5 o F ) на уровне моря ( 30 дюймов ртутного столба ).
- 1 британская тепловая единица = 1055,06 Дж = 107,6 тыс. Куб.
Элемент, использующий один киловатт-час электроэнергии, произведет 3412 британских тепловых единиц.
Высшая и более низкая теплотворная способность
Энергетическая ценность или теплотворная способность такая же, как теплота сгорания , и может быть рассчитана на основе термодинамических величин или измерена в подходящем оборудовании:
Сгорает известное количество топлива при постоянном давлении и стандартных условиях (0 ° C и 1 бар) и выделяемое тепло улавливается известной массой воды в калориметре.Если начальная и конечная температуры воды измеряются, выделяемая энергия может быть рассчитана с использованием уравнения
H = ΔT mC p
где H = поглощенная тепловая энергия (в Дж), ΔT = изменение температуры (в ° C), m = масса воды (в г) и C p = удельная теплоемкость (4,18 Дж / г ° C для воды). Полученное значение энергии, разделенное на граммы сожженного топлива, дает содержание энергии (в Дж / г).
В процессе сгорания образуется водяной пар, и можно использовать определенные методы для рекуперации количества тепла, содержащегося в этом водяном паре, путем его конденсации.
- Высшая теплотворная способность (= Высшая теплотворная способность — GCV = Высшая теплотворная способность — HHV) — вода сгорания полностью конденсируется, а тепло, содержащееся в водяном паре, рекуперируется
- Низкая теплотворная способность (= нетто Теплотворная способность — NCV = Нижняя теплотворная способность — LHV) — продукты сгорания содержат водяной пар, а тепло водяного пара не восстанавливается
В таблице ниже приведены валовая и чистая теплотворная способность ископаемого топлива, а также некоторых альтернативные виды биотоплива.
См. Также Теплота сгорания, ископаемые и альтернативные виды топлива — Энергосодержание и сжигание топлива — Выбросы двуокиси углерода
Для полной таблицы с более низкой теплотой сгорания LHV — поверните экран!
Топливо Плотность Высокая теплотворная способность (HHV)
(Полная теплотворная способность — GCV)Теплотворная способность — NCV) при 0 ° C / 32 ° F, 1 бар Газообразное топливо [кг / м 3 ] [г / фут 3 ][кВтч / кг] [МДж / кг] [БТЕ / фунт] [МДж / м 3 ] / фут 3 ] [кВтч / кг] [МДж / кг] [БТЕ / фунт] [МДж / м 3 ] БТЕ / фут 3 ] Ацетилен 1.097 31,1 13,9 49,9 21453 54,7 1468 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 Водород 0,090 2,55 39,4 141,7 60920 12.7 341 33,3 120,0 51591 10,8 290 Метан 0,716 20,3 15,4 15,4 5515,5 50,0 21496 35,8 964 Природный газ (рынок США) * 0,777 22,0 14,5 52.2 22446 40,6 1090 13,1 47,1 20262 36,6 983 9015 9015 9015 9015 48152 9015 при 15 ° C / 60 ° F Жидкое топливо [кг / л] 9088 [кВтч / кг] [МДж / кг] [БТЕ / фунт] [МДж / л] [БТЕ / галлон] кВт] [МДж / кг] [БТЕ / фунт] [МДж / л] [БТЕ / галлон] 0151 Ацетон.787 2,979 8,83 31,8 13671 25,0 89792 8,22 29,6 12726 9015 9015 49,1 21109 29,5 105875 12,58 45,3 19475 27,2 97681 Бутанол 0.810 10,36 37,3 16036 30,2 108359 9,56 34,4 14789 34,4 14789 27,9 99934 9015 9015 9015 9015 45,6 19604 38,6 138412 11,83 42,6 18315 36,0 129306 Диметиловый эфир (DME) 665 2,518 8,81 31,7 13629 21,1 75655 8,03 28,9 12425 19,2 6816973 51,9 22313 29,7 106513 13,28 47,8 20550 27,3 98098 Этанол (100%) 0.789 2,987 8,25 29,7 12769 23,4 84076 7,42 26,7 11479 21,1 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 11,94 43,0 18487 30,8 110464 Бензин (бензин) * 0.737 2,790 12,89 46,4 19948 34,2 122694 12,06 43,4 18659 32,0 9015 3,180 11,95 43,0 18495 36,1 129654 11,89 42,8 18401 36,0 128991 Gly15263 4,781 5,28 19,0 8169 24,0 86098 Мазут * 0,98 11106 9015 9015 0,98 9015 9015 146974 10,83 39,0 16767 38,2 137129 Керосин * 0,821 3.108 12,83 46,2 19862 37,9 126663 11,94 43,0 18487 35,3 126663 9015 9015 9015 126663 9015 9015 44,0 18917 42,2 151552 11,28 40,6 17455 39,0 139841 СПГ * 0.428 1,621 15,33 55,2 23732 23,6 84810 13,50 48,6 20894 20,8 9015 9015 49,3 21195 26,5 94986 12,64 45,5 19561 24,4 87664 Судовое газойль * 0.855 3,237 12,75 45,9 19733 39,2 140804 11,89 42,8 18401 36,6 9015 9015 9015 9015 9015 9015 9015 9015 3 23,0 9888 18,2 65274 5,54 19,9 8568 15,8 56562 Метиловый эфир (биодизель3) 888 3,361 11,17 40,2 17283 35,7 128062 10,42 37,5 16122 37,5 16122 33,3 119460 9015E 9015 9015 38,0 16337 28,2 101244 9,75 35,1 15090 26,1 93517 Масла растительные (биодизель) * 0.92 3,483 11,25 40,5 17412 37,3 133684 10,50 37,8 16251 34,8 12416773 34,8 12416772 34,8 12416772 9015 12,78 46,0 19776 41,4 148538 11,53 41,5 17842 37,4 134007 90.63 2,385 13,50 48,6 20894 30,6 109854 12,60 45,4 19497 28,6 102503 9015 9015 9015 9015 9015 9015 48,1 20679 34,9 125145 12,47 44,9 19303 32,6 116819 Пропан 498 1.885 13,99 50,4 21647 25,1 89963 12,88 46,4 19927 23,1 41,8 150072 10,97 39,5 16982 39,2 140470 Смола * 10.00 36,0 15477 Скипидар 0,865 3,274 44,0 Твердое топливо * [кВтч / кг] [МДж / кг] [БТЕ / фунт] [кВтч / кг] кг] [БТЕ / фунт] Антрацитовый уголь 9.06 32,6 14015 Битуминозный уголь 8,39 30,2 12984 8152 9015 9015 9015 9015 9015 9015 29015 9,11 32,8 14101 Древесный уголь 8.22 29,6 12726 7,89 28,4 12210 Кокс 7,22 уголь) 3,89 14,0 6019 Торф 4.72 17,0 7309 Нефтяной кокс 8,69 31,3 8,69 31,3 13453 9015 9015 9015 9015 9015 13457 8,19 29,5 12683 Полубитуминозный уголь 6.78 24,4 10490 Сера (с) 2,56 9,2 3955 3955 Древесина (сухая) 0,701 4,50 16,2 6965 4,28 15,4 6621 смеси различных видов топлива между сезонами и рынками.Приведены значения для топлива с заданной плотностью. Разница в качестве может давать значения нагрева на 5-10% выше или ниже заданного значения. Кроме того, твердые виды топлива будут иметь одинаковые вариации качества для разных классов топлива.
- 1 БТЕ (IT) / фунт = 2,3278 МДж / т = 2327,8 Дж / кг = 0,55598 ккал / кг = 0,000646 кВтч / кг
- 1 ккал / кг = 1 кал / г = 4,1868 МДж / т = 4186,8 Дж / кг = 1,8 БТЕ (IT) / фунт = 0,001162 кВтч / кг
- 1 МДж / кг = 1000 Дж / г = 1 ГДж / т = 238.85 ккал / кг = 429,9 британских тепловых единиц (ИТ) / фунт = 0,2778 кВт · ч / кг
- 1 кВт · час / кг = 1547,7 британских тепловых единиц (ИТ) / фунт = 3,597 ГДж / т = 3597,1 кДж / кг = 860,421 ккал / кг
- 1 британская тепловая единица (ИТ) / фут 3 = 0,1337 британских тепловых единиц (ИТ) / галлон (жидкий эквивалент США) = 0,03531 британских тепловых единиц (ИТ) / л = 8,89915 ккал / м 3 = 3,7259×10 4 Дж / м 3
- 1 британская тепловая единица (IT) / галлон (американский жидкий раствор) = 0,2642 британских тепловых единиц (ИТ) / л = 7,4805 британских тепловых единиц (ИТ) / фут 3 = 66,6148 ккал / м 3 = 2,7872×10 5 Дж / м 3
- 1 МДж / м 3 = 26.839 британских тепловых единиц (ИТ) / фут 3 = 3,5879 британских тепловых единиц (ИТ) / галлон (жидкие тепловые единицы США) = 0,94782 британских тепловых единиц (ИТ) / л = 239,01 ккал / м 3
- 1 ккал / м2 3 = 0,11237 британских тепловых единиц (IT) / фут 3 = 0,01501 британских тепловых единиц (ИТ) / галлон (жидких единиц США) = 0,003966 британских тепловых единиц (ИТ) / л = 4186,8 Дж / м 3
Молярная теплота сгорания топлива Руководство по химии
Пожалуйста не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!Молярная теплота сгорания (молярная энтальпия сгорания) некоторых обычных веществ, используемых в качестве топлива
Углеводороды, такие как алканы, и спирты, такие как алканолы, могут использоваться в качестве топлива.
Когда алкан полностью сгорает в избытке газообразного кислорода, продуктами реакции являются диоксид углерода (CO 2 (г) ) и вода (H 2 O (г) , которая конденсируется до H 2 O (л) при комнатной температуре и давлении).
алкан + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
Молярная теплота сгорания алкана (молярная энтальпия сгорания алкана) — это количество тепловой энергии, выделяющейся, когда 1 моль алкана сгорает в избытке газообразного кислорода.
Когда алканол полностью сгорает в избытке газообразного кислорода, продуктами реакции являются диоксид углерода (CO 2 (г) ) и вода (H 2 O (г) , которая конденсируется до H 2 O). (л) при комнатной температуре и давлении).
алканол + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
Молярная теплота сгорания алканола (молярная энтальпия сгорания алканола) — это количество тепловой энергии, выделяющейся, когда 1 моль алканола сгорает в избытке газообразного кислорода.
Чтобы определить молярную теплоту сгорания , нам необходимо определить, сколько моль вещества было израсходовано в реакции горения, поэтому вещество должно быть чистым. 1
Молярная теплота сгорания (молярная энтальпия сгорания) некоторых обычных алканов и спиртов, используемых в качестве топлива, представлена в таблице ниже в единицах килоджоулей на моль (кДж-моль -1 ) 2 .
Обратите внимание, что химические уравнения, представляющие каждую из реакций горения, сбалансированы таким образом, что используется 1 моль сгоревшего вещества, топлива.
Реакция горения происходит в избытке газообразного кислорода, избыток O 2 (г) , поэтому вполне нормально использовать доли O 2 (г) , чтобы сбалансировать уравнение, потому что нас действительно интересует только энергия, выделяемая на моль топлива, а не на моль газообразного кислорода.Вещество
(топливо)Молярная теплота сгорания
(кДж моль -1 )Реакция горения ΔH реакция
(кДж моль -1 )метан 890 CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (л) ΔH = -890 этан 1560 C 2 H 6 (г) + 7 / 2 O 2 (г) → 2CO 2 (г) + 3H 2 O (л) ΔH = -1560 пропан 2220 C 3 H 8 (г) + 5O 2 (г) → 3CO 2 (г) + 4H 2 O (л) ΔH = -2220 бутан 2874 C 4 H 10 (г) + 13 / 2 O 2 (г) → 4CO 2 (г) + 5H 2 O (л) ΔH = -2874 октановое число 5460 C 8 H 18 (г) + 25 / 2 O 2 (г) → 8CO 2 (г) + 9H 2 O (л) ΔH = -5460 метанол
(метиловый спирт)726 CH 3 OH (л) + 3 / 2 O 2 (г) → CO 2 (г) + 2H 2 O (л) ΔH = -726 этанол
(этиловый спирт)1368 C 2 H 5 OH (л) + 3O 2 (г) → 2CO 2 (г) + 3H 2 O (л) ΔH = -1368 пропан-1-ол
(1-пропанол)2021 C 3 H 7 OH (л) + 9 / 2 O 2 (г) → 3CO 2 (г) + 4H 2 O (л) ΔH = -2021 бутан-1-ол
(1-бутанол)2671 C 4 H 9 OH (л) + 6O 2 (г) → 4CO 2 (г) + 5H 2 O (л) ΔH = -2671 Из таблицы видно, что 1 моль газообразного метана, CH 4 (г) , подвергается полному сгоранию в избытке газообразного кислорода, выделяя 890 кДж тепла.
Молярная теплота сгорания газообразного метана приведена в таблице как положительное значение, 890 кДж · моль -1 .
Изменение энтальпии при сгорании газообразного метана указано в таблице как отрицательное значение, ΔH = -890 кДж · моль -1 , потому что реакция производит энергию (это экзотермическая реакция).
Мы могли бы написать химическое уравнение для представления сгорания 1 моля газообразного метана как:CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (г) ΔH = -890 кДж моль -1
Но сколько энергии выделяется, если 2 моля метана полностью сгорают?
Когда мы пишем химическое уравнение для этой реакции, мы должны умножить каждый член на два ( × 2 ), включая значение ΔH:2 × CH 4 (г) + 2 × 2O 2 (г) → 2 × CO 2 (г) + 2 × 2H 2 O (г) ΔH = 2 × -890 кДж моль -1
2 CH 4 (г) + 4 O 2 (г) → 2 CO 2 (г) + 4 H 2 O (г) ΔH = -1780 кДж моль -1
2 моля метана полностью сгорят с выделением 2 × 890 = 1780 кДж тепла.
Точно так же, если у нас есть только половина моля метана, который подвергается полному сгоранию, мы должны умножить каждый член в химическом уравнении, включая значение ΔH, на ½ , как показано в химических уравнениях ниже:
½ × CH 4 (г) + ½ × 2O 2 (г) → ½ × CO 2 (г) + ½ × 2H 2 O (г) ΔH = ½ × -890 кДж моль -1
½ CH 4 (г) + O 2 (г) → ½ CO 2 (г) + H 2 O (г) ΔH = -445 кДж моль -1
½ моля метана сгорело бы с выделением ½ × 890 = 445 кДж тепла.
Как правило, количество тепловой энергии, выделяемой при сгорании n молей топлива, равно значению молярной теплоты сгорания топлива, умноженной на количество молей сгоревшего топлива.
выделенного тепла (кДж) = n (моль) × молярная энтальпия сгорания (кДж моль -1 )
(дополнительные примеры таких расчетов см. В Руководстве по расчетам изменений энтлапии для учебного пособия по химическим реакциям)
В этом разделе мы рассмотрели, как использовать таблицы значений молярной энтальпии сгорания чистых веществ, чтобы рассчитать, сколько тепловой энергии будет выделено, когда известные количества вещества будут сожжены в избытке газообразного кислорода.
Но откуда берутся эти значения?
Значения молярной энтальпии сгорания могут быть определены с помощью лабораторных экспериментов.
В следующем разделе мы обсудим эксперимент, который вы могли бы провести, чтобы определить молярную теплоту сгорания спирта.Измерение молярной теплоты сгорания жидкого топлива (измерение молярной энтальпии сгорания жидкого топлива)
В школьной лаборатории можно определить молярную теплоту сгорания (энтальпию сгорания) жидкого топлива, такого как спирт, используя процедуру, описанную ниже: 3
- В колбу, химический стакан или банку наливают известное количество воды.
- Термометр расположен так, чтобы его груша (резервуар) находилась в середине объема воды.
- В спиртовку помещается известное количество топлива, например спирт (алканол).
- Начальная температура воды измеряется и записывается (T i ).
- Фитиль спиртовой горелки горит, сжигая топливо и нагревая воду.
- Когда температура воды значительно повысилась, спиртовая горелка гаснет, и максимальная достигнутая температура записывается как конечная температура (T f ).
- Конечное количество топлива измеряется и записывается.
Типичные результаты эксперимента, в котором энергия, выделяемая при полном сгорании этанола, используется для нагрева 200 г воды, показаны ниже:
начальная температура воды (T i ) = 20 ° C горелка с начальной массой + этанол (m i ) = 37,25 г конечная температура воды (T f ) = 75 ° C Конечная массагорелки + этанол (m f ) = 35.50 г изменение температуры воды
= T f — T i
= 75-20
= 55 ° Cэтанола по массе, используемого в реакции горения
= m i — m f
= 37,25 — 35,50
= 1,75 гПримечание:
- Температура воды увеличивается, поскольку при сгорании топлива выделяется энергия, которая нагревает воду.
- Масса топлива уменьшается, поскольку оно расходуется в реакции сгорания.
Результаты этого эксперимента можно затем использовать для расчета молярной теплоты сгорания этанола (молярной энтальпии сгорания этанола), как показано ниже:
Шаги для расчета молярной энтальпии сгорания этанола с использованием этих экспериментальных результатов:
- Рассчитать количество молей (n) израсходованного топлива
моль = масса ÷ молярная масса
масс использованного этанола = 1.75 г (из опыта)
молярная масса (M) этанола (C 2 H 5 OH)
= (2 × 12,01) + (6 × 1,008) + 16,00 (из периодической таблицы)
= 46,1 г моль -1
n (этанол) = масса ÷ молярная масса
= 1,75
г÷ 46,1гмоль -1= 0,0380 моль
- Рассчитайте энергию, необходимую для изменения температуры воды:
энергия, поглощенная водой = удельная теплоемкость воды × масса воды × изменение температуры воды
удельная теплоемкость воды = c г = 4.184 Дж ° C -1 г -1 (технический паспорт)
масса воды = 200 г (из опыта)
изменение температуры воды = 55 ° C (из эксперимента)
энергии, поглощенной водой = 4,184 Дж
° C -1 г -1× 200г× 55° C= 46024 Дж
Преобразуйте энергию в Дж в кДж, разделив на 1000:
энергия = 46024
Дж÷ 1000Дж/ кДж= 46.


