несколько графиков и аналитических данных —
Давление пара измеряет количество паров, присутствующих в рассматриваемой системе.
По мере повышения температуры все больше и больше паров улетучивается под действием сил молекулярного притяжения из жидкой фазы в газообразное состояние, что повышает давление пара. График давления пара и температуры дает представление о количестве молекул, перешедших в газообразную форму.
- График зависимости давления насыщенного пара от температуры
- График зависимости давления пара от температуры
- График зависимости ln(P) от/s 1/T
Каждая жидкость имеет определенную температуру кипения в зависимости от химического состава и количества водородных связей. Выше точки кипения температура жидкости не повышается, а фаза жидкости переходит в газообразное состояние.
Давление пара соответствует температуре или тепловой энергии, выделяемой при испарении паров. Температура жидкости повышается до точки кипения жидкости, и, таким образом, давление пара над поверхностью кипящей жидкости поддерживается постоянным, это называется давлением пара насыщения.График зависимости давления насыщенного пара от температуры
Температура жидкости повышается до точки кипения жидкости, и, таким образом, давление пара над поверхностью кипящей жидкости поддерживается постоянным, это называется давлением пара насыщения.График зависимости давления насыщенного пара от температуры
Если мы посмотрим на приведенный выше график зависимости давления пара от температуры, TF это температура, при которой жидкость начинает кипеть. При этой температуре температура жидкости больше не повышается, а давление пара увеличивается до определенного значения и достигает насыщения, эта длина кривой обозначается как насыщение кривой давления пара.
Как только температура жидкости достигает точки кипения, захваченная тепловая энергия превращается в кинетическую энергию, молекулы разрывают межмолекулярные связи и испаряются с поверхности жидкости. Но когда пары испаряются, тепловая энергия пара отдается, и пар охлаждается и, в конце концов, конденсируется, образуя капли жидкости, и стекает в объем, поэтому количество паров над поверхностью жидкости остается постоянным, и, следовательно, мы говорят, что давление пара достигает точки кипения.
Если вы сохраните объем воды для кипячения и измерите изменения давления пара над уровнем кипящей воды, вы заметите, что давление пара будет экспоненциально увеличиваться с повышением температуры.
Построим график зависимости давления пара от температуры воды. Давление пара на каждые 100°С повышения температуры воды от 00°С до 1000°С регистрируют до тех пор, пока не точка кипения воды.
| Температура (Т0 C) | Давление пара (торр) |
| 0 | 4.6 |
| 10 | 9.2 |
| 20 | 17.5 |
| 30 | 31.8 |
| 40 | 55.3 |
| 50 | 92.5 |
| 60 | 149 |
| 70 | 234 |
| 80 | 355 |
| 90 | 526 |
| 100 | 760 |
График зависимости давления пара от температуры представляет собой экспоненциальную кривую.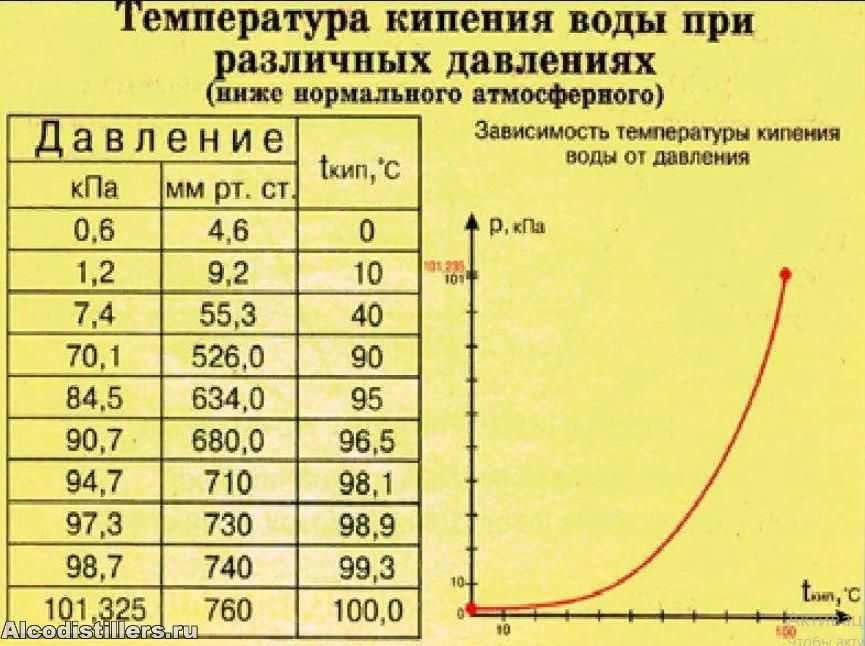 При температуре замерзания воды давление пара составляет 4.6 торр, а конечное давление газа которое также называется давлением насыщенного пара, как обсуждалось выше, составляет 760 торр.График зависимости давления пара от температуры воды
При температуре замерзания воды давление пара составляет 4.6 торр, а конечное давление газа которое также называется давлением насыщенного пара, как обсуждалось выше, составляет 760 торр.График зависимости давления пара от температуры воды
За этим давление пара при температуре кипения воды, давление пара не увеличивается, так как водяной пар конденсируется и падает вниз под действием силы тяжести. Первоначально при низкой температуре, поскольку количество теплоты, переданное воде, меньше, очень небольшое количество паров будет способно перейти в паровую форму.
По мере повышения температуры воды все больше и больше молекул разрывают связи и улетучиваются в атмосферу в виде паров в зависимости от температуры. Следовательно, температура воды прямо пропорциональна давлению пара, образующемуся над поверхностью кипящей воды.
Как найти давление пара по графику?Мы видели, что график зависимости давления пара от температуры показывает экспоненциальный характер.
Таким образом, наклон графика ln(P) v/s 1/T даст величину отношения теплоты парообразования к газовой постоянной, по которой можно найти давление пара.
Экспоненциальную функцию зависимости давления паров от температуры от температуры мы можем сформулировать как
Где А — константа, связанная с температурой кипения.
R — газовая постоянная, равная 8.314 Дж/К.моль.
теплота парообразования жидкости P
Решив это уравнение с помощью логарифмирования, получим,
Это в виде линейного уравнения,
Таким образом, мы можем построить график зависимости lnP от/s 1/T, и наклон графика даст нам значение
График зависимости ln(P) от/s 1/T
Приведенный выше график также удовлетворяет уравнению Клаузиуса-Клапейрона, согласно которому разница температур зависит от давления пара в системе.
Найдя наклон этого графика, мы найдем значение Подставляя это значение в уравнение (1), мы можем найти давление пара при любой температуре жидкости.
Данный: T1= -100С = -10+273=263К
T2= 200С =20+273=293К
P1=10кПа
P2=48кПа
Используя уравнение Клауссиуса – Клапейрона
Теплота парообразования хлороформа 32.6кДж/моль
Чему равно давление пара при температуре 600C, если наклон графика зависимости ln(P) от температуры, обратной зависимости от температуры, равен 360.8 К? Кроме того, найти теплоту парообразования.Наклон графика ln(P) v/s 1/T равен
Следовательно,
Т = 600С= 60+273=333К
У нас есть,
Таким образом, давление пара при температуре 600С составляет 2.95 кПа.
ОглавлениеОТ ИЗДАТЕЛЬСТВАИЗ ПРЕДИСЛОВИЯ К ПЕРВОМУ ИЗДАНИЮ ВВЕДЕНИЕ Глава I. Кинематика § 1. Движение тел § 2. Кинематика. Относительность движения и покоя. § 3. Траектория движения § 4.  Поступательное и вращательное движения тела Поступательное и вращательное движения тела§ 5. Движение точки § 6. Описание движения точки § 7. Измерение длины § 8. Измерение промежутков времени § 9. Равномерное прямолинейное движение и его скорость § 10. Знак скорости при прямолинейном движении § 11. Единицы скорости § 12. Графики зависимости пути от времени § 13. Графики зависимости скорости от времени § 14. Неравномерное прямолинейное движение § 15. Мгновенная скорость § 16. Ускорение при прямолинейном движении § 17. Скорость прямолинейного равноускоренного движения § 18. Знак ускорения при прямолинейном движении § 19. Графики скорости при прямолинейном равноускоренном движении § 20. Графики скорости при произвольном неравномерном движении § 21. Нахождение пути, пройденного при неравномерном движении, при помощи графика скорости § 22. Путь, пройденный при равнопеременном движении § 23. Векторы § 24. Разложение вектора на составляющие § 25. Криволинейное движение § 26. 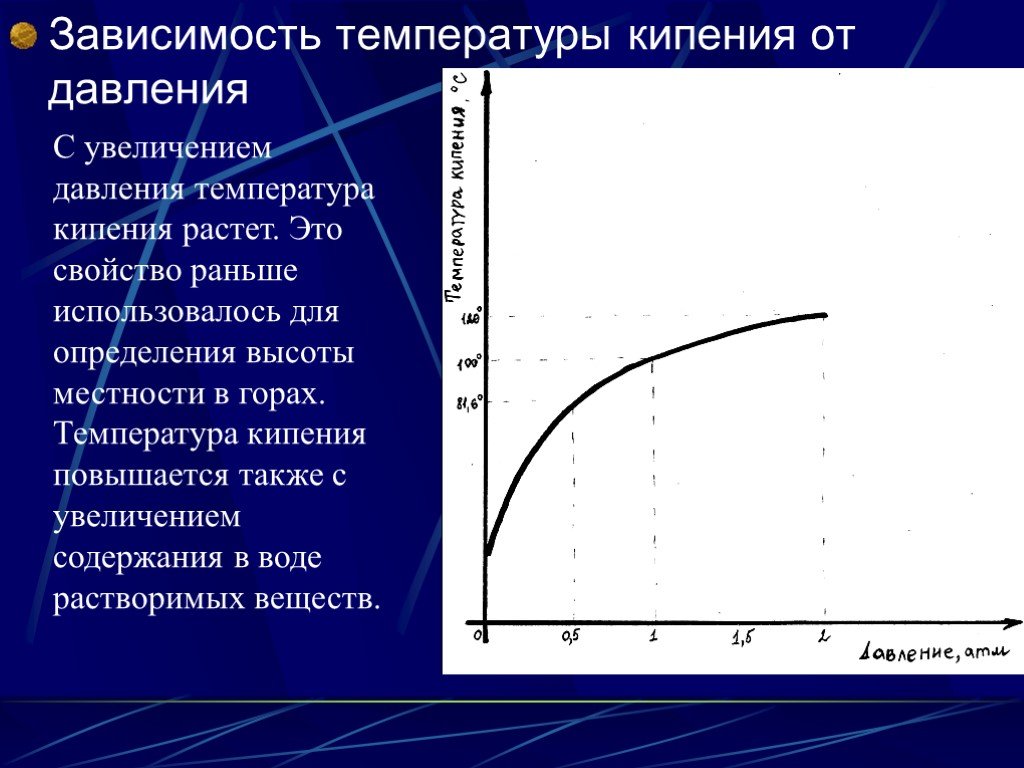 Скорость криволинейного движения Скорость криволинейного движения§ 27. Ускорение при криволинейном движении § 28. Движение относительно разных систем отсчета § 29. Кинематика космических движений Глава II. Динамика § 30. Задачи динамики § 31. Закон инерции § 32. Инерциальные системы отсчета § 33. Принцип относительности Галилея § 34. Силы § 35. Уравновешивающиеся силы. О покое тела и о движении по инерции § 37. Динамометры § 38. Точка приложения силы § 39. Равнодействующая сила § 40. Сложение сил, направленных по одной прямой § 41. Сложение сил, направленных под углом друг к другу § 42. Связь между силой и ускорением § 43. Масса тела § 44. Второй закон Ньютона § 45. Единицы силы и массы § 46. Системы единиц § 47. Третий закон Ньютона § 48. Примеры применения третьего закона Ньютона § 49. Импульс тела § 50. Система тел. Закон сохранения импульса § 51. Применения закона сохранения импульса § 52.  Свободное падение тел Свободное падение тел§ 53. Ускорение свободного падения § 54. Падение тела без начальной скорости и движение тела, брошенного вертикально вверх § 55. Вес тела § 56. Масса и вес § 57. Плотность вещества § 58. Возникновение деформаций § 59. Деформации в покоящихся телах, вызванные действием только сил, возникающих при соприкосновении § 60. Деформации в покоящихся телах, вызванные силой тяжести § 61. Деформации тела, испытывающего ускорение § 62. Исчезновение деформаций при падении тел § 63. Разрушение движущихся тел § 64. Силы трения § 65. Трение качения § 66. Роль сил трения § 67. Сопротивление среды § 68. Падение тел в воздухе Глава III. Статика § 69. Задачи статики § 70. Абсолютно твердое тело § 71. Перенос точки приложения силы, действующей на твердое тело § 72. Равновесие тела под действием трех сил § 73. Разложение сил на составляющие § 74. Проекции сил. Общие условия равновесия § 75. Связи.  Силы реакции связей. Тело, закрепленное на оси Силы реакции связей. Тело, закрепленное на оси§ 76. Равновесие тела, закрепленного на оси § 77. Момент силы § 78. Измерение момента силы § 79. Пара сил § 81. Определение центра тяжести тел § 82. Различные случаи равновесия тела под действием силы тяжести § 83. Условия устойчивого равновесия под действием силы тяжести § 84. Простые машины § 85. Клин и винт Глава IV. Работа и энергия § 86. «Золотое правило» механики § 87. Применения «золотого правила» § 88. Работа силы § 89. Работа при перемещении, перпендикулярном к направлению силы § 90. Работа силы, направленной под любым углом к перемещению § 91. Положительная и отрицательная работа § 92. Единица работы § 93. О движении по горизонтальной плоскости § 94. Работа силы тяжести при движении по наклонной плоскости § 95. Принцип сохранения работы § 96. Энергия § 97. Потенциальная энергия § 98. Потенциальная энергия упругой деформации § 99. 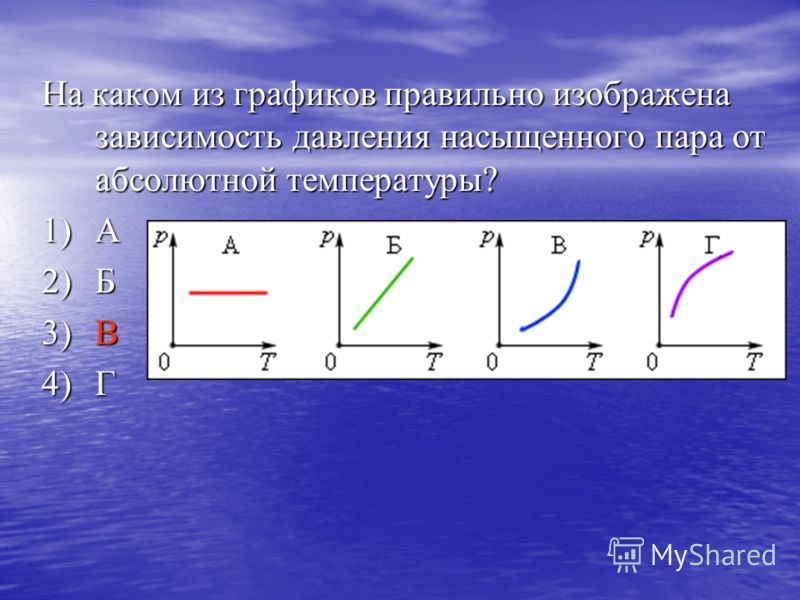 Кинетическая энергия Кинетическая энергия§ 100. Выражение кинетической энергии через массу и скорость тела § 101. Полная энергия тела § 102. Закон сохранения энергии § 103. Силы трения и закон сохранения механической энергии § 104. Превращение механической энергии во внутреннюю энергию § 105. Всеобщий характер закона сохранения энергии § 106. Мощность § 107. Расчет мощности механизмов § 108. Мощность, быстроходность и размеры механизма § 109. Коэффициент полезного действия механизмов Глава V. Криволинейное движение § 110. Возникновение криволинейного движения § 111. Ускорение при криволинейном движении § 112. Движение тела, брошенного в горизонтальном направлении § 113. Движение тела, брошенного под углом к горизонту § 114. Полет пуль и снарядов § 115. Угловая скорость § 116. Силы при равномерном движении по окружности § 117. Возникновение силы, действующей на тело, движущееся по окружности § 118. Разрыв маховиков § 119. Деформация тела, движущегося по окружности 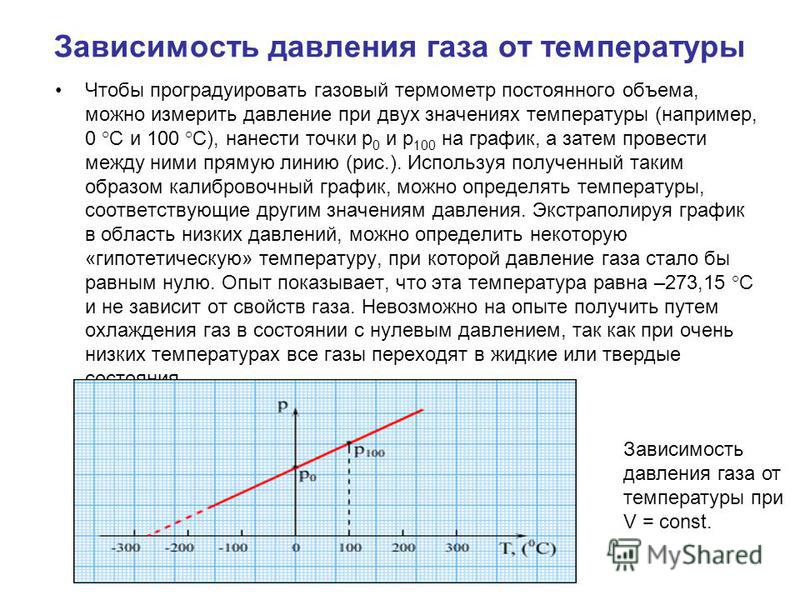 «Американские горки» «Американские горк軧 121. Движение на закруглениях пути § 122. Движение подвешенного тела по окружности § 123. Движение планет § 124. Закон всемирного тяготения § 125. Искусственные спутники Земли Глава VI. Движение в неинерциальных системах отсчета и силы инерции § 126. Роль системы отсчета § 127. Движение относительно разных инерциальных систем отсчета § 128. Движение относительно инерциальной и неинерциальной систем отсчета § 129. Поступательно движущиеся неинерциальиые системы § 130. Силы инерции § 131. Эквивалентность сил инерции и сил тяготения § 132. Невесомость и перегрузки § 133. Является ли Земля инерциальиой системой отсчета? § 134. Вращающиеся системы отсчета § 135. Силы инерции при движении тела относительно вращающейся системы отсчета § 136. Доказательство вращения Земли § 137. Приливы Глава VII. Гидростатика § 138. Подвижность жидкости § 139. Силы давления § 140. Измерение сжимаемости жидкости § 141.  «Несжимаемая» жидкость «Несжимаемая» жидкость§ 142. Силы давления в жидкости передаются во все стороны § 143. Направление сил давления § 144. Давление § 145. Мембранный манометр § 146. Независимость давления от ориентации площадки § 147. Единицы давления § 148. Определение сил давления по давлению § 149. Распределение давления внутри жидкости § 150. Закон Паскаля § 151. Гидравлический пресс § 152. Жидкость под действием силы тяжести § 153. Сообщающиеся сосуды § 154. Жидкостный манометр § 155. Устройство водопровода. Нагнетательный насос § 156. Сифон § 157. Сила давления на дно сосуда § 158. Давление воды в морских глубинах § 159. Прочность подводной лодки § 160. Закон Архимеда § 161. Измерение плотности тел на основании закона Архимеда § 163. Плавание несплошных тел § 164. Устойчивость плавания кораблей § 165. Всплывание пузырьков § 166. Тела, лежащие на дне сосуда Глава VIII. Аэростатика § 167.  Механические свойства газов Механические свойства газов§ 168. Атмосфера § 169. Давление атмосферы § 170. Другие опыты, показывающие существование атмосферного давления § 171. Разрежающие насосы § 172. Влияние атмосферного давления на уровень жидкости в трубке § 173. Максимальная высота столба жидкости § 174. Опыт Торричелли. Ртутный барометр и барометр-анероид § 175. Распределение атмосферного давления по высоте § 176. Физиологическое действие пониженного давления воздуха § 177. Закон Архимеда для газов § 178. Воздушные шары и дирижабли § 179. Применение сжатого воздуха в технике Глава IX. Гидродинамика и аэродинамика § 180. Давление в движущейся жидкости § 181. Течение жидкости по трубам § 182. Закон Бернулли § 183. Жидкость в неинерциальных системах отсчета § 184. Реакция движущейся жидкости и ее использование § 185. Перемещение на воде § 186. Ракеты § 187. Реактивные двигатели § 188. Баллистические ракеты § 189. Взлет ракеты с Земли § 190.  Сопротивление воздуха Сопротивление воздуха§ 191. Эффект Магиуса и циркуляция § 192. Подъемная сила крыла и полет самолета § 193. Турбулентность в потоке жидкости или газа § 194. Ламинарное течение РАЗДЕЛ ВТОРОЙ. ТЕПЛОТА. МОЛЕКУЛЯРНАЯ ФИЗИКА Глава X. Тепловое расширение твердых и жидких тел § 195. Тепловое расширение твердых и жидких тел § 196. Термометры § 197. Формула линейного расширения § 198. Формула объемного расширения § 199. Связь между коэффициентами линейного и объемного расширения § 200. Измерение коэффициента объемного расширения жидкостей Глава XI. Работа. Теплота. Закон сохранения энергии § 202. Изменения состояния тел § 203. Нагревание тел при совершении работы § 204. Изменение внутренней энергии тел при теплопередаче § 205. Единицы количества теплоты § 206. Зависимость внутренней энергии тела от его массы и вещества § 207. Теплоемкость тела § 208. Удельная теплоемкость § 209. 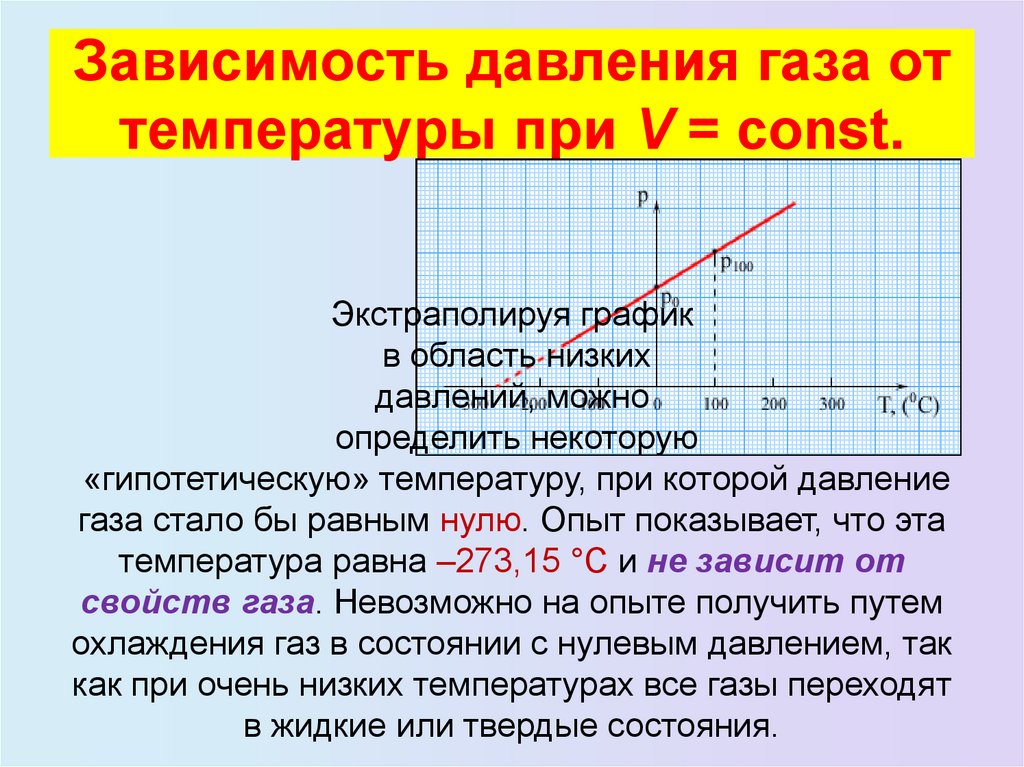 Калориметр. Измерение теплоемкостей Калориметр. Измерение теплоемкостей§ 210. Закон сохранения энергии § 211. Невозможность «вечного двигателя» § 212. Различные виды процессов, при которых происходит передача теплоты Глава XII. Молекулярная теория § 213. Молекулы и атомы § 214. Размеры атомов и молекул § 215. Микромир § 216. Внутренняя энергия с точки зрения молекулярной теории § 217. Молекулярное движение § 218. Молекулярное движение в газах, жидкостях и твердых телах § 219. Броуновское движение § 220. Молекулярные силы Глава XIII. Свойства газов § 221. Давление газа § 222. Зависимость давления газа от температуры § 223. Формула, выражающая закон Шарля § 224. Закон Шарля с точки зрения молекулярной теории § 225. Изменение температуры газа при изменении его объема. Адиабатические и изотермические процессы § 226. Закон Бойля — Мариотта § 227. Формула, выражающая закон Бойля — Мариотта § 228. График, выражающий закон Бойля — Мариотта § 229.  Зависимость между плотностью газа и его давлением Зависимость между плотностью газа и его давлением§ 230. Молекулярное толкование закона Бойля — Мариотта § 231. Изменение объема газа при изменении температуры § 232. Закон Гей-Люссака § 233. Графики, выражающие законы Шарля и Гей-Люссака § 234. Термодинамическая температура § 235. Газовый термометр § 236. Объем газа и термодинамическая температура § 237. Зависимость плотности газа от температуры § 238. Уравнение состояния газа § 239. Закон Дальтона § 240. Плотность газов § 241. Закон Авогадро § 242. Моль. Постоянная Авогадро § 243. Скорости молекул газа § 244. Об одном из способов измерения скоростей движения молекул газа (опыт Штерна) § 245. Удельные теплоемкости газов § 246. Молярные теплоемкости § 247. Закон Дюлонга и Пти Глава XIV. Свойства жидкостей § 248. Строение жидкостей § 249. Поверхностная энергия § 250. Поверхностное натяжение § 251. Жидкостные пленки § 252. Зависимость поверхностного натяжения от температуры § 253.  Смачивание и несмачивание Смачивание и несмачивание§ 254. Расположение молекул у поверхности тел § 255. Значение кривизны свободной поверхности жидкости § 256. Капиллярные явления § 257. Высота поднятия жидкости в капиллярных трубках § 258. Адсорбция § 259. Флотация § 260. Растворение газов § 261. Взаимное растворение жидкостей § 262. Растворение твердых тел в жидкостях Глава XV. Свойства твердых тел. Переход тел из твердого состояния в жидкое § 263. Введение § 264. Кристаллические тела § 265. Аморфные тела § 266. Кристаллическая решетка § 267. Кристаллизация § 268. Плавление и отвердевание § 269. Удельная теплота плавления § 270. Переохлаждение § 271. Изменение плотности веществ при плавлении § 272. Полимеры § 273. Сплавы § 274. Затвердевание растворов § 275. Охлаждающие смеси § 276. Изменения свойств твердого тела Глава XVI. Упругость и прочность § 277. Введение § 278. Упругие и пластические деформации § 279.  Закон Гука Закон Гука§ 280. Растяжение и сжатие § 281. Сдвиг § 282. Кручение § 283. Изгиб § 284. Прочность § 285. Твердость § 286. Что происходит при деформации тел § 287. Изменение энергии при деформации тел Глава XVII. Свойства паров § 288. Введение § 289. Пар насыщенный и ненасыщенный § 290. Что происходит при изменении объема жидкости и насыщенного пара § 291. Закон Дальтона для пара § 292. Молекулярная картина испарения § 293. Зависимость давления насыщенного пара от температуры § 294. Кипение § 295. Удельная теплота парообразования § 296. Охлаждение при испарении § 297. Изменение внутренней энергии при переходе вещества из жидкого состояния в парообразное § 298. Испарение при кривых поверхностях жидкости § 299. Перегревание жидкости § 300. Пересыщение паров § 301. Насыщение пара при возгонке § 302. Превращение газа в жидкость § 303. Критическая температура § 304. Сжижение газов в технике § 305.  Вакуумная техника Вакуумная техника§ 306. Водяной пар в атмосфере Глава XVIII. Физика атмосферы § 307. Атмосфера § 308. Тепловой баланс Земли § 309. Адиабатические процессы в атмосфере § 310. Облака § 311. Искусственные осадки § 312. Ветер § 313. Предсказание погоды Глава XIX. Тепловые машины § 314. Условия, необходимые для работы тепловых двигателей § 315. Паросиловая станция § 316. Паровой котел § 317. Паровая турбина § 318. Поршневая паровая машина § 319. Конденсатор § 320. Коэффициент полезного действия теплового двигателя § 321. Коэффициент полезного действия паросиловой станции § 322. Бензиновый двигатель внутреннего сгорания § 323. Коэффициент полезного действия двигателя внутреннего сгорания § 324. Двигатель Дизеля § 325. Реактивные двигатели § 326. Передача теплоты от холодного тела к горячему Ответы и решения к упражнениям Предметный указатель |
Учебное пособие по диаграммам давления и температуры паров
Инструменты Creator скоро будут вдохновлять!
Присоединяйтесь к списку рассылки, чтобы узнать, когда мы запустимся.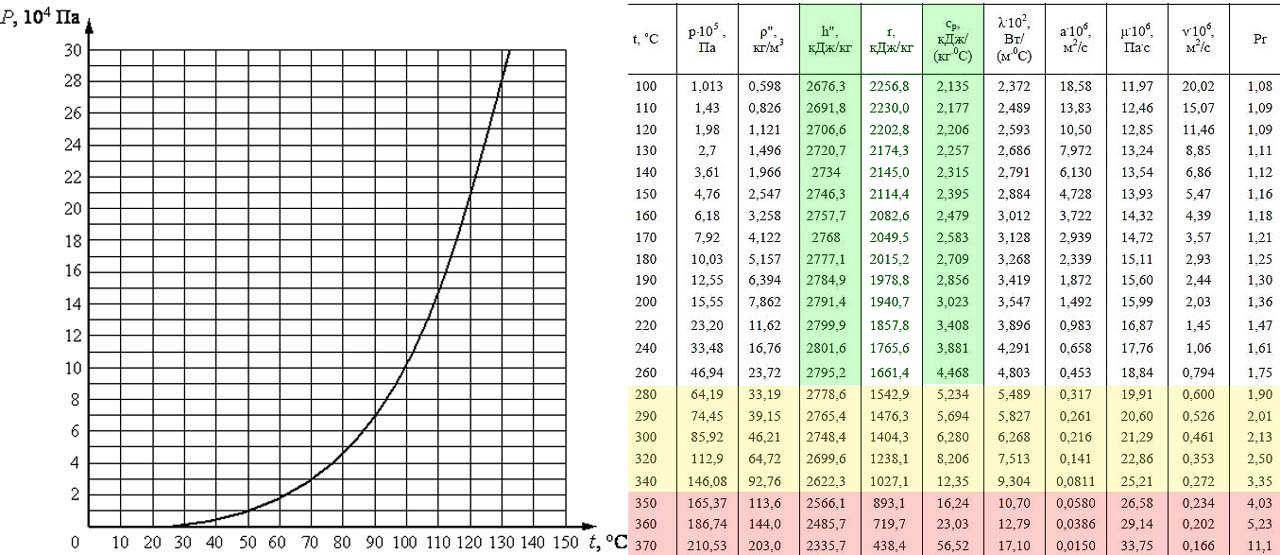
Химия
Общая химия
Состояние вещества
Руководство по диаграммам давления и температуры пара
Кристалл
HS-PS1-4
Давление паровой фазы может быть определено как давление пара при стекании заданная температура в закрытой системе. Это делается в состоянии термодинамического равновесия.
Мы все видели, как мама готовила чай или кофе на кухне. Первое, что нужно сделать для приготовления чая, это вскипятить воду. Вскипятить воду может каждый, но если мы попросим вас вскипятить воду быстрее, как вы это сделаете?
Вы можете увеличить огонь, повернув ручку плиты, чтобы увеличить пламя, или второй и самый эффективный способ — закрыть крышку контейнера, чтобы вода быстрее закипела. Давление, которое будет создаваться в емкости, поможет увеличить скорость закипания.
ЧТО ОЗНАЧАЕТ ВЫСОКАЯ ТЕМПЕРАТУРА КИПЕНИЯ?
Высокая температура кипения измеряет температуру, при которой жидкость закипает.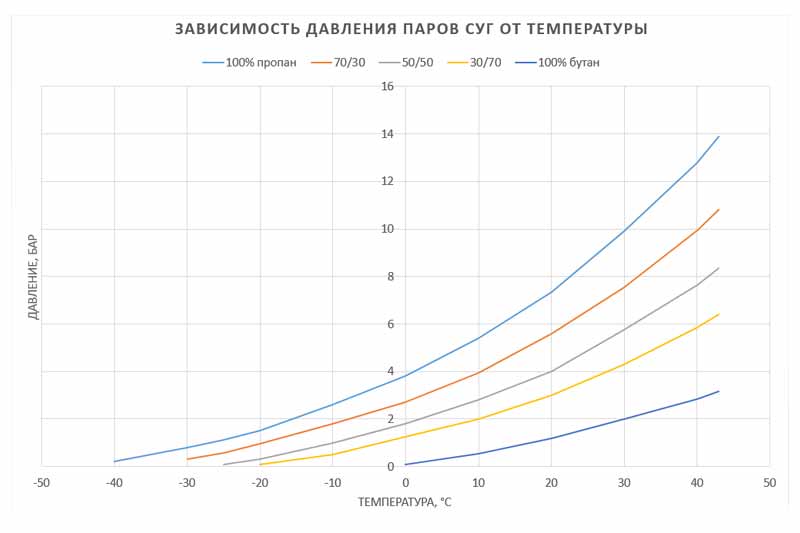 Как и в случае с температурой плавления, более высокая температура кипения подразумевает большие межмолекулярные силы и, следовательно, меньшее давление паров.
Как и в случае с температурой плавления, более высокая температура кипения подразумевает большие межмолекулярные силы и, следовательно, меньшее давление паров.
Источник
КРИВАЯ ДАВЛЕНИЯ ПАРА
- График зависимости температуры от давления пара создан для контроля различных точек кипения различных жидкостей.
- Из кривых давления пара видно, что разные жидкости имеют разные температуры кипения.
- Существует стандарт давления, в соответствии с которым проведена горизонтальная линия, обозначающая давление.
- Температура кипения жидкостей указывает на образование сильных межмолекулярных сил.
- Следовательно, из графика зависимости температуры от давления пара мы получим imf (межмолекулярная сила) и давление пара .
Источник
ФОРМУЛА ДАВЛЕНИЯ ПАРА
Первый метод: Закон Рауля для давления пара выглядит следующим образом:
P раствор = X растворитель * P растворитель
Где,
- P раствор = давление паров раствора
- X растворитель = мольная доля растворителя
- P растворитель = давление паров чистого растворителя
Второй метод: можно использовать уравнение Клаузиуса-Клапейрона :
ln(P1/P2) = (ΔH vap /R)((1/T2) — (1/T1))
Где,
- ΔH vap : Энтальпия испарения жидкости.

- R: Реальная газовая постоянная, или 8,314 Дж/(К × моль).
- T1: Начальная температура.
- T2: Конечная температура
- P1 и P2: Давление паров при температурах T1 и T2 соответственно.
Часто задаваемые вопросы:
1. Какая связь между температурой и давлением паров?
С повышением температуры жидкости молекулы начинают двигаться быстрее. Это приводит к образованию газа, что приводит к увеличению давления пара. Таким образом, температура прямо пропорциональна давлению пара.
2. Как читать график зависимости давления пара от температуры?
Поскольку температура и давление пара прямо пропорциональны друг другу, их соответствующий график будет представлять собой прямую линию.
3. Какой из графиков показывает зависимость между температурой кипения и давлением пара?
Если давление пара высокое, это означает, что межмолекулярные силы низкие. Таким образом, высокая температура не требуется, что приводит к низкой температуре кипения. Поскольку давление пара и температура кипения обратно пропорциональны друг другу, соответствующий им график будет иметь форму гиперболы.
Таким образом, высокая температура не требуется, что приводит к низкой температуре кипения. Поскольку давление пара и температура кипения обратно пропорциональны друг другу, соответствующий им график будет иметь форму гиперболы.
4. Какая связь между точкой кипения, давлением паров и температурой вещества и атмосферным давлением?
Температура кипения регистрируется в момент, когда давление паров жидкости соответствует атмосферному давлению. Таким образом, при повышении температуры температура кипения снижается, но давление пара и атмосферное давление увеличиваются.
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о графике давления пара и температуры ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на вопросы и пообщаться с другими учениками, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности — мы обещаем, что это сделает учебу намного веселее! -Давление. НАРАЙНА-КИНЕТИЧЕСКАЯ ТЕОРИЯ УРОВНЯ ГАЗОВ-V РЕКЛАМА Аб Падхай каро бина адс ке Хариэдо Д.Н. Про и дехо сари видео бина киси ад ки рукаават ке! Обновлено: 27-06-2022 Текст Решение Ответ Правильный ответ B Решение ρ=PMRT или ρ∝PT Ответить Пошаговое решение, разработанное экспертами, чтобы помочь вам в решении вопросов и получении отличных оценок на экзаменах. Видео по теме График зависимости давления от температуры идеального газа, как показано на рис. 11446313 На рисунке показаны графики зависимости давления от плотности идеального газа при две температуры T_(1) и T_(2) Что правильно? . 11881366 График зависимости давления от плотности идеального газа показан на рис. идеального газа, как показано на рисунке. Плотность газа в точке А равна ρ0. Плотность в точке B будет ____ 606264315 P-V диаграмма идеального газа для процесса ABC показана на рисунке. 642769841 Текст Решение График зависимости давления идеального газа от температуры показан на рисунке. Плотность газа в точке A равна rho_0. Плотность в точке B будет равна: 642778781 График зависимости давления от плотности идеального газа показан на рисунке 643188909 График зависимости давления от температуры идеального газа показан на рисунке. По состоянию на 7 марта 2022 г.
По состоянию на 7 марта 2022 г. График зависимости давления идеального газа от температуры показан на рисунке. Плотность газа в точке А равна Р(0). Плотность в B будет
(PT)A=P0T0 и (PT)B=(32)P0T0
(PT)B=32(PT)A∴ρB=32ρA=32ρ0. Соответствующий график зависимости плотности (rho) от объема (V) будет
Соответствующий график зависимости плотности (rho) от объема (V) будет
Постройте график зависимости давления от плотности газа для процесса ABC.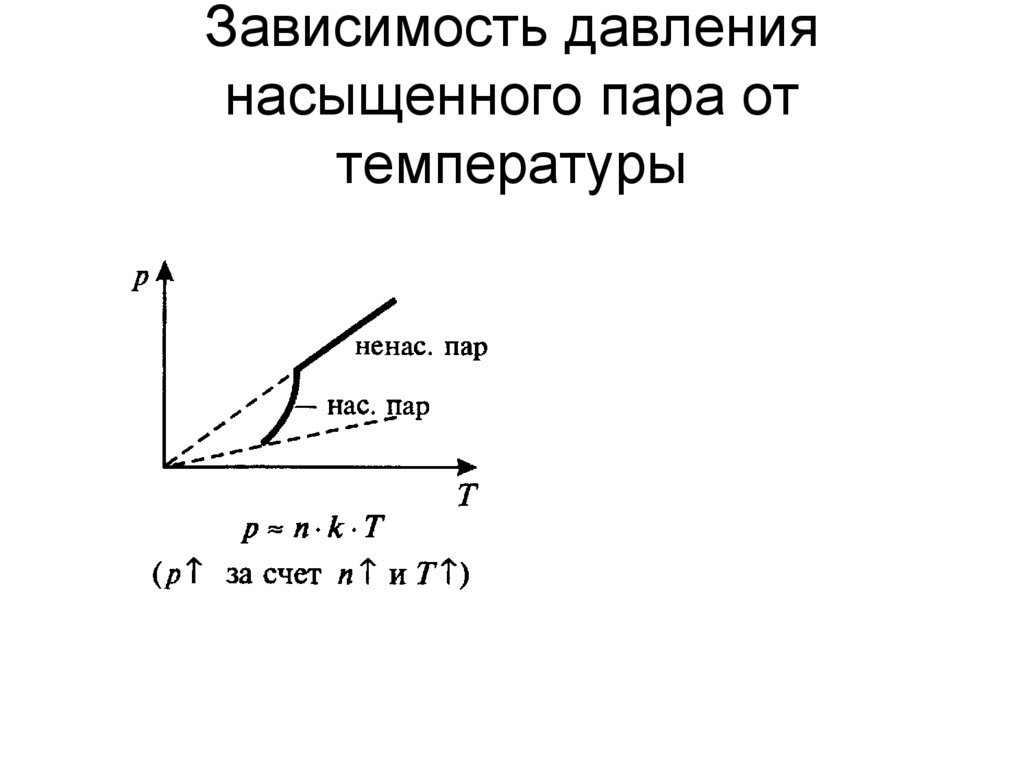

 С. Элементарный учебник физики. Т.1. Механика. Теплота. Молекулярная физика. — М.: Наука, 1985. — 606 c.
С. Элементарный учебник физики. Т.1. Механика. Теплота. Молекулярная физика. — М.: Наука, 1985. — 606 c.