Ионизация воды
23 июня, 2020
Ионизация воды
Как известно, химическая формула воды h3O. Однако, несмотря на одинаковую формулу вода может обладать совершенно различными химическими и физическими свойствами. Например, дождевая вода значительно отличается от морской или минеральной воды.
Электролиз
Один из способов, позволяющий изменять свойства воды – это электролиз. После электролиза полученная вода называется ионизированной. Она приобретает уникальные свойства, которые максимально соответствуют внутренней среде организма человека и могут существенно улучшить жизненные процессы.
Ионизация воды, используемая в медико-биологических целях, направлена главным образом на дробление крупных молекулярных кластеров воды для насыщения её мономолекулами и активными ионами. В ходе регулируемого с помощью различных способов, систем и устройств процесса активации-ионизации исследуемого объема воды, в нем изменяются химический состав, физические свойства и внутренняя структура.
Вода с измельченными кластерами и насыщенная активными ионами обладает более высокими реактивными и растворяющими свойствами, лучше проникает через биологические мембраны, быстрее выводит из организма отходы его жизнедеятельности. Кластер активированной воды содержит в среднем 5-6 молекул (обычной воды 13-16 молекул). Более активная по биофизическим и биохимическим показателям ионизированная вода оптимизирует все обменные процессы в организме, что в конечном итоге способствует продлению срока его нормального функционирования, т.е. увеличению продолжительности здоровой жизни. При употреблении предварительно подготовленной ионизированной воды снижается количество нерационально расходуемой организмом внутренней энергии на доведение физико-химических параметров обычной крупнокластерной воды до значений оптимальных для ее усвоения и расходования организмом.
«Живая вода»
Исследованиями установлено, что наиболее полезная для здоровья ионизированная вода или, так называемая «живая вода», известная в мире под названием «Alkaline Water»( щёлочная вода -англ.). Она имеет выраженную щёлочную реакцию, существенно отрицательное значение окислительно-восстановительного потенциала (ОВП). Несомненная польза ионизированной щёлочной воды проявляется в нейтрализации нарастающей кислотной нагрузки на организм — бича жителей крупных и средних городов. Загрязнённая среда, неправильное питание, преобладание в рационе кислых продуктов, недостаточное потребление чистой воды и другие факторы приводят к закислению организма.
Активированная электролизом ионизированная вода, обладая высокой текучестью и растворяющей способностью, эффективно заменяет и дополняет собой большинство очищающих пищевых добавок и физиотерапевтических процедур. Поэтому может использоваться для комплексной очистки организма: нейтрализации и выведения шлаков, токсинов, канцерогенов и радионуклидов.
Многие ученые-медики, использовавшие ионизированную воду на практике указывали, что она увеличивает продолжительность жизни клеток человека в искусственно созданных неблагоприятных условиях в 10-15 раз. Также ускоряет регенерацию здоровых клеток. При диагностике по методу доктора Фолля, всего один глоток этой воды воздействует на уровень энергетики организма аналогично тщательно подобранному гомеопатическому комплексу. Снижает утомляемость у водителей, пользователей компьютеров, у владельцев мощных радиотелефонов. Полностью снимает «синдром утренней усталости», токсикоз при беременности. Многократно увеличивает вероятность появления здорового потомства у людей, проживающих в экологически неблагоприятных зонах. Значительно увеличивает эффективность воздействия физиотерапевтических приборов и физиотерапевтических процедур. Усиливает усвояемость витаминно-минеральных комплексов, чтоо позволяет сократить время достижения положительного эффекта, уменьшить дозировки препаратов на 20-50%. Значительно улучшает самочувствие при гриппе и ОРЗ, резко снижает вероятность осложнений.
При диагностике по методу доктора Фолля, всего один глоток этой воды воздействует на уровень энергетики организма аналогично тщательно подобранному гомеопатическому комплексу. Снижает утомляемость у водителей, пользователей компьютеров, у владельцев мощных радиотелефонов. Полностью снимает «синдром утренней усталости», токсикоз при беременности. Многократно увеличивает вероятность появления здорового потомства у людей, проживающих в экологически неблагоприятных зонах. Значительно увеличивает эффективность воздействия физиотерапевтических приборов и физиотерапевтических процедур. Усиливает усвояемость витаминно-минеральных комплексов, чтоо позволяет сократить время достижения положительного эффекта, уменьшить дозировки препаратов на 20-50%. Значительно улучшает самочувствие при гриппе и ОРЗ, резко снижает вероятность осложнений.
Что такое ионизатор? Принцип работы ионизаторов.
Что такое ионизатор? Принцип работы ионизаторов.
Что такое электролизер (ионизатор или активатор)? Что такое живая и мертвая вода?
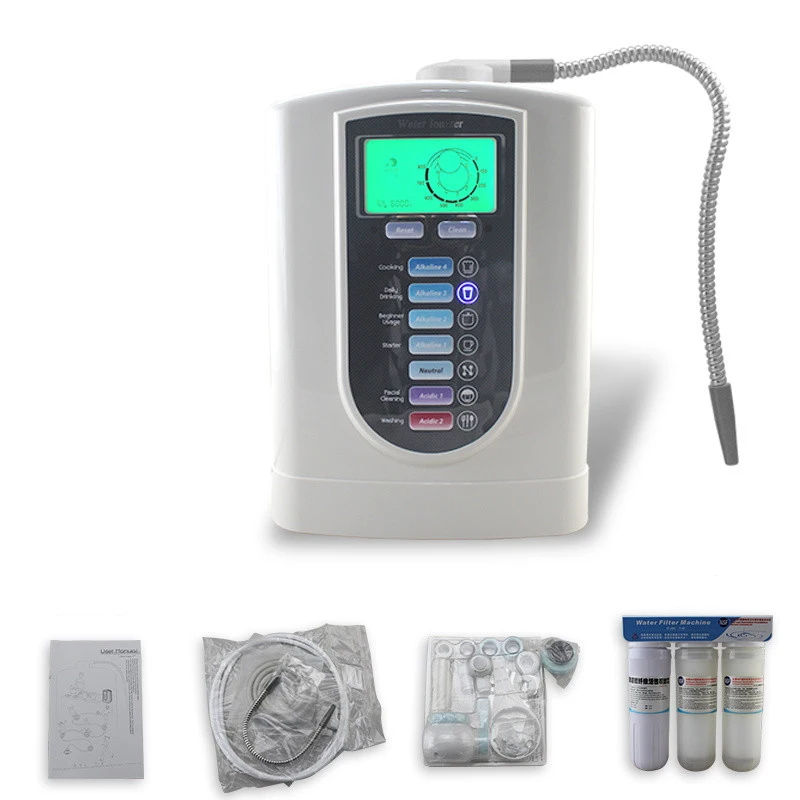
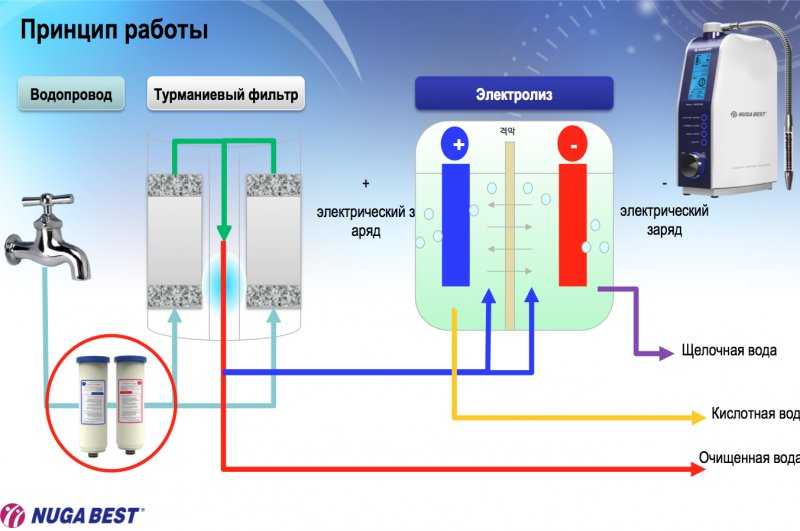
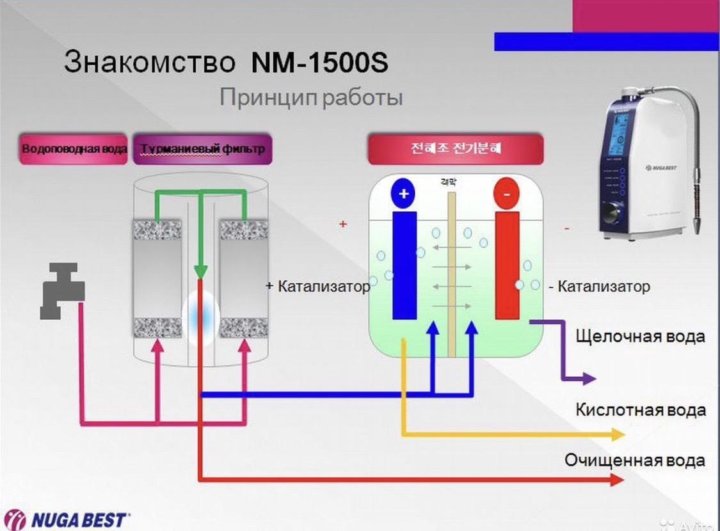
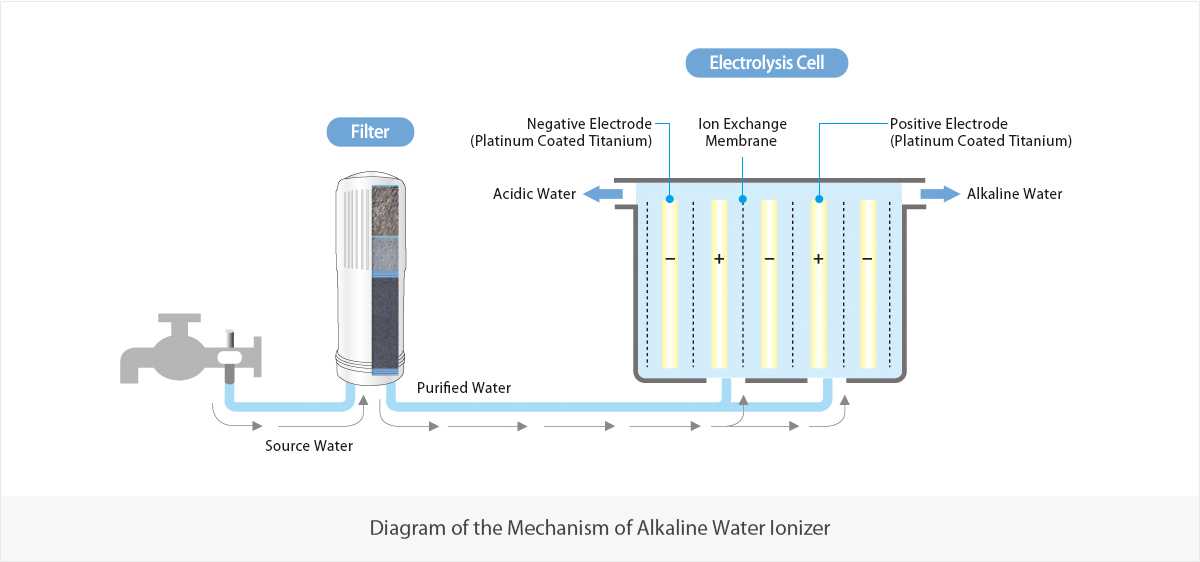
Часто электролизеры еще называют ионизаторами или же активаторами воды. Но правильнее все-таки их называть электролизерами, так как это название отражает суть происходящих в приборах процессов. В ионизаторах вода разделяется на две — щелочную воду с pH больше 8 и кислотную воду с pH меньше 6. Щелочную воду в России называют «живой», а кислотную — «мертвой» водой.
Принцип работы ионизаторов воды
Ионизатор представляет собой прибор, в котором 2 или более электродов, погружены в раствор солей в воде.
Если есть 2 электрода: Анод — положительно заряженный электрод А(+) иКатод — отрицательно заряженный электрод К(-).
Чтобы сделать процессы более интенсивными, в более дорогих электролизерах используют несколько пластин электродов.
Какие процессы происходят в электролизере?
Как подсказывает название, в электролизере происходит процесс электролиза. Электролиз — это разложение вещества на составляющие при помощи электрического тока. Ток через химически чистую (дистиллированную или еще более чистую, деионизированную воду идет очень слабо, поэтому электролиз чистой воды затруднителен. Попробуйте залить в бытовой ионизатор дистиллированную воду, он работать не будет.
Электролиз — это разложение вещества на составляющие при помощи электрического тока. Ток через химически чистую (дистиллированную или еще более чистую, деионизированную воду идет очень слабо, поэтому электролиз чистой воды затруднителен. Попробуйте залить в бытовой ионизатор дистиллированную воду, он работать не будет.
Электролиз обычной питьевой воды, например, взятой из-под крана, возможен именно благодаря присутствию воде разных солей, например, кальция, натрия, магния и др. Для работы электролизеров важно, чтобы солей было достаточно, для чего воду дополнительно минерализуют.
Фактически речь идет об электролизе водного раствора солей.
Самые распространенные соли в питьевой воде: гидрокарбонаты, сульфаты кальция, магния, хлорид натрия (он же — поваренная соль).
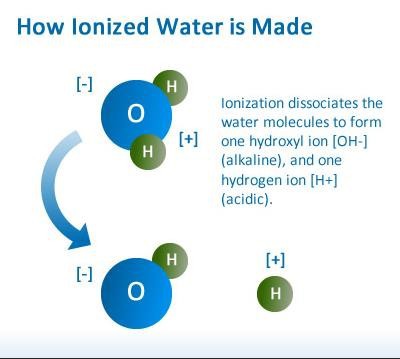
Растворяясь в воде, соли распадаются (диссоциируют) на ионы — частицы, имеющие электрический заряд. Кроме того, сами молекулы воды тоже, частично, диссоциируют на H+ и OH-
В питьевой воде «плавают»:
— положительно заряженные Ca2+, Mg2+ ,Na+, K+ , H+
— отрицательно заряженные HCO3-, SO42-, Cl-, OH-.
На этикетках бутылированной воды в России всегда указывается список ионов. Под действием электрического поля ионы начинают двигаться к электроду с противоположным зарядом, где с ними происходят химические реакции.
Сразу оговоримся, что электроды должны быть инертными, то есть при электролизе они служат лишь передатчиками электронов. Материал таких электродов не участвует в электродных процессах (это может быть, например, Pt (платина), Ir (иридий), то есть сами электроды в реакции не участвуют. Иначе сначала будет реагировать и разрушаться (растворяться) сам электрод: Ме (металл) —> Me+ + е-, прежде чем начнутся другие реакции. Понятно, что электроды из платины или иридия очень дороги, поэтому их делают с покрытием из платины и качество этого покрытия принципиально важно.
Т.к. все металлы, ионы которых имеются в нашей питьевой воде — Ca, Mg, Na, K — стоят в ряду напряжений металлов левее алюминия включительно, то на катоде металл не восстанавливается, а восстанавливается водород из воды. Это происходит так: На катоде (-) 2 молекулы воды соединяются с электронами и образуется газ водород и ионы OH- — т.е щелочная среда.
Это происходит так: На катоде (-) 2 молекулы воды соединяются с электронами и образуется газ водород и ионы OH- — т.е щелочная среда.
K(-) 2h3O + 2e‾ → h3 + 2OH-
На аноде (+) происходит несколько реакций:1) Так как к нас присутствует анион кислородсодержащей кислоты, (SO42-), то происходит окисление атомов кислорода из воды до молекул кислорода и еще образуются ионы водорода H+:
2h3O — 4e → O2 + 4H+, выделяется газ кислород и образуется кислотная среда — ионы водорода H+2) В нашем случае есть также анион бескислородной кислоты ( Cl-). Происходит его окисление до простого вещества:
образуется газообразный хлор
2Cl- — 2e → Cl2
Итак, на отрицательном электроде выделяется газ водород и щелочная среда, на положительном — газы кислород, хлор и кислотная среда. Нужно учитывать, что хлор — ядовитый газ.
Но важно, что продукты реакций будут смешиваться и реагировать между собой.
При этом смешении образуется гипохлорит по реакции:
Cl2+2OH- → Cl-+ClO-h3O
А затем, при комнатной температуре в кислом растворе образуется хлорат (соединение хлорноватистой кислоты) по реакции:
2HClO+ClO- → ClO3-+2H+2Cl-
Какие вещества, выделяемые в электролизерах, имеют терапевтический эффект
Мы видим, что среди веществ, выделяющихся на катоде, есть молекулярный водород h3.
То, что водород действует как терапевтический антиоксидант, селективно восстанавливая цитотоксичные радикалы кислорода, открыл профессор Охта только в 2007 году. Подтвердили и широко изучают эти эффекты только с 2010-х годов.
На сегодняшний день однозначно научно доказано, что из всех веществ, производимых в ионизаторах полезен только водород, а не щелочность или что-то еще.
Ионизаторы (электролизеры) существуют на рынке уже десятки лет. Они появились в Японии в начале 20 века, а широко рекламируются с 1950-70х годов.Они появились в Японии в начале 20 века, а широко рекламируются с 1950-70х годов. Тогда не знали, что полезен именно водород, думали, что важна щелочность, или, что пользу ионизированной воде дает лактат кальция, который добавляли в воду для большей минерализации, или что пользу приносит понижение ОВП само по себе — впоследствии оказалось, что понижение ОВП полезно, если вызвано растворением водорода.
Было еще много разных теорий, например о структурированной воде, но они не подтвердились.
Ионизаторы не проектировались для производства воды с высоким содержанием растворенного водорода. Ионизаторы делались как приборы для производства щелочной, а не водородной воды. Их электроды конструировались, так, чтобы наиболее эффективно вырабатывалась щелочная вода, а не насыщенная водородом.
Поэтому электролизеры могут давать и очень маленькое, нетерапевтическое, количество растворенного водорода в воде, ведь важно, чтобы водород не только выделился, но и растворился.
Но зато мы обязательно получим кислотный раствор, щелочной раствор, а если в воде изначально были ионы хлора, например, из растворенной соли, то и газ хлор и хлораты, растворенные в воде.
Приборы, которые специально создавались для насыщения воды водородом, без примесей посторонних веществ, но зато с максимальной концентрацией водорода в воде, и которые могут работать с дистиллированной водой — это генераторы водородной воды с протонообменной мембраной.
Такие генераторы могут работать также и с дистиллированной водой, и водой очищенной способом обратного осмоса, наличие в воде солей необязательно.
Ионизация воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 50887
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан 9{-} ({вод})\]
Отдельные молекулы не остаются ионизированными в течение длительного времени, реакция идет быстро в обе стороны от равновесия. Анимация выше показывает механизм Гротгуса, в котором протоны туннелируют от одной молекулы воды к другой через водородные связи. Аналогично происходит автоионизация воды с выделением ионов H + и OH – , которые рекомбинируют за считанные фемтосекунды. Время жизни разделенных ионов составляет около 70 микросекунд и зависит от степени водородных связей, поэтому оно короче при более низких температурах.
 9{-6} \номер\конец{выравнивание}\]
9{-6} \номер\конец{выравнивание}\](Поскольку даже в разбавленных растворах закон равновесия не соблюдается точно, результаты большинства расчетов равновесия округляются до трех значащих цифр. Следовательно, значение dm
–6 является достаточно точным для всех таких вычислений.)K w зависит от прочности водородной связи. Следовательно, на него влияют те же факторы, что и на образование водородных связей: Температура , давление , концентрация растворенного вещества и ионная сила . K w удваивается при давлении около 100 МПа. [1] При –35 o C, в переохлажденной воде K w составляет приблизительно 1 x 10 –17 . При высоких температурах и давлениях, хотя K w ведет себя более сложно, вода становится все более ионизированной. При более высоких температурах (~комнатная температура) одна молекула воды в 5,5 x 10 8 ионизирован, по сравнению с одной из 840 молекул при 1000 o C и 10 МПа.
 [2] В следующей таблице показаны значения K w и нейтрального pH в зависимости от температуры. Взято из Harned and Owen, 1958. [3] На следующем рисунке показана зависимость p K w от более широкого диапазона температур.
[2] В следующей таблице показаны значения K w и нейтрального pH в зависимости от температуры. Взято из Harned and Owen, 1958. [3] На следующем рисунке показана зависимость p K w от более широкого диапазона температур.Таблица \(\PageIndex{1}\) Температурная зависимость K w
Температура o С К ш р К ш рН нейтрального раствора
[Н + ] = [ОН
0 0,12 x 10 –14 14,93 7,47 15 0,45 x 10 –14 14,35 7,18 20 0,68 x 10 –14 14,17 7,08 25 1,01 x 10 –14 14.  00
007,00 30 1,47 x 10 –14 13,83 6,92 40 2,95 x 10 –14 13,53 6,76 Ионная сила влияет на ионизацию воды, K w достигает максимума 2 x 10 –14 моль 2 л –2 при ионной силе около 0,25 М (хлорид триметиламмония) и уменьшается до 1 x 10 –14 моль 2 l –2 при повышении ионной силы до 5 М. [1] K w имеет тенденцию к увеличению в присутствии органических соединений. [2]
Несмотря на то, что степень ионизации невелика (2,8 x 10 –9 при 37 o C), диссоциация воды имеет важное значение во всех биологических системах, включая пищевые продукты.
 Помимо действия в качестве смазки, очищающей жидкости, транспортной среды (питательных веществ и отходов) в живых системах. Автоионизационная способность воды делает ее высокоэффективной средой для протонного обмена и участия по существу в четырех типах реакций: окислении, восстановлении, гидролизе и конденсации.
Помимо действия в качестве смазки, очищающей жидкости, транспортной среды (питательных веществ и отходов) в живых системах. Автоионизационная способность воды делает ее высокоэффективной средой для протонного обмена и участия по существу в четырех типах реакций: окислении, восстановлении, гидролизе и конденсации. Константа равновесия K w применима не только к чистой воде, но и к любому водному раствору при 25°C. Так, например, если к H 2 O добавить 1,00 моль сильной кислоты HNO 3 , используемой в методах определения зольности пищевых продуктов, чтобы получить общий объем 1 дм 3 , практически все HNO 9{-3}\конец{выравнивание}\]
Добавление HNO 3 к H 2 O не только увеличивает концентрацию ионов гидроксония, но также снижает концентрацию ионов гидроксида с исходных 10 –7 моль дм –3 до еще более минута 10 –14 моль дм –3 .

Пример \(\PageIndex{1}\) Концентрация ионов
Рассчитайте концентрацию ионов гидроксония в растворе 0,516 M Mg(OH) 2 . 9{-3} \nonumber \end{align} \]
Из ChemPRIME: 14.1: Ионизация воды
Ссылки
- ↑ Chaplin, M. 2009. http://www1.lsbu.ac.uk/water/index2.html
- ↑ Вода: Матрица жизни 2-е изд. (Королевское химическое общество) 2000. Ф. Франкс.
- ↑ Физическая химия растворов электролитов, 3-е изд. 1958. Харнед, Х.С. и Оуэн, Б.Б. .
Авторы и ссылки
Эд Витц (Университет Куцтауна), Джон У. Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавьер Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан .
Эта страница под названием «Ионизация воды» публикуется в соответствии с лицензией CC BY-NC-SA 4.0, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон У. Мур, Джастин Шорб, Ксавье Прат-Ресина, Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Теги
- Образец
Ионизация воды — природа воды, подробное объяснение самоионизации воды и ионов чистой воды, постоянная продукта, а также часто задаваемые вопросы
Что такое ионизация?
Ионизация определяется как процесс, при котором атом или молекула приобретает или теряет положительный или отрицательный заряд в результате химических изменений.
 Ион представляет собой электрически заряженный атом или молекулу, образующуюся в результате. Если ион имеет отрицательный заряд, он называется анионом; если он имеет положительный заряд, он называется катионом.
Ион представляет собой электрически заряженный атом или молекулу, образующуюся в результате. Если ион имеет отрицательный заряд, он называется анионом; если он имеет положительный заряд, он называется катионом.Основная реакция ионизации может быть представлена следующим образом:
М → М + + е –
Ионизация может происходить в результате потери электрона при столкновениях с субатомными частицами, столкновениях с другими атомами, молекулами и ионами или при взаимодействии с электромагнитным излучением.
Содержание
- Амфипротическая природа воды
- Самоионизация воды
- Константа ионного произведения чистой воды
- Взаимосвязь между pH, pOH и pKw
- Часто задаваемые вопросы – Часто задаваемые вопросы
Амфипротическая природа воды
Из-за своей высокополярной структуры жидкая вода может действовать либо как кислота (отдавая протон основанию), либо как основание (используя неподеленную пару электронов для принятия протона).
В качестве основы:
Когда сильная кислота, такая как HCl, растворяется в воде, она разделяется на ионы хлорида (Cl – ) и протоны (H + ). В свою очередь протон реагирует с молекулой воды с образованием иона гидроксония (H 3 O + ):
HCl (водн.) + H 2 O(ж) → H 3 O + (водн.) + Cl – (водн.)
Кислотой в этой реакции является HCl, а основанием является вода, которая принимает ион H + .
Кислоты:
Вода также может действовать как кислота. H 2 O отдает протон NH 3 , который действует как основание, в этой равновесной реакции:
H 2 O(водн.) + NH 3 (водн.) ⇆ (NH 4 ) + + OH –
Вода поэтому называется амфипротной, потому что она может действовать как кислота или основание в зависимости от природы другого реагента.

Самоионизация воды
Вода самоионизируется в очень небольшой степени при нормальных условиях. Реакция, при которой молекула воды отдает один из своих протонов соседней молекуле воды либо в чистой воде, либо в водном растворе, называется самоионизацией воды. 9{2}}\конец{массив} \)
В результате количество диссоциированных молекул воды очень мало.
Равновесие реакции автоионизации смещено далеко влево, при этом диссоциирует небольшое количество молекул воды. В результате реакция автоионизации оставляет [H 2 O] практически неизменной и может рассматриваться как константа. Включив эту константу в выражение равновесия, мы можем изменить уравнение константы равновесия, чтобы определить новую константу равновесия, константу продукта ионов жидкой воды (K 9{-2} \end{массив} \)
При 25°C константа равновесия K w относится к любому водному раствору, а не только к чистой воде.
- Концентрации ионов гидроксония и ионов гидроксида равны в чистой воде, поэтому раствор нейтрален.
- Если [H 3 O + ] > [OH – ], раствор кислый.
- Если [H 3 O + ] < [OH – ], раствор является щелочным.
H 3 9Концентрация 0056 O + в водном растворе является количественной мерой кислотности: чем выше концентрация H 3 O + , тем кислее раствор. Напротив, чем выше концентрация ОН – , тем более щелочным является раствор.
Связь между pH, pOH и pK
wШкала рН представляет собой краткий способ описания концентрации H 3 O + в растворе и, следовательно, его кислотности или щелочности. 9{-}\конец{массив} \)
pK w = pH + pOH
Так как, pK w = 14
рН + рОН = 14.
При 25°С,
pH + pOH = 14,00 для любого нейтрального раствора с pH = pOH = 7.
Часто задаваемые вопросы по ионизации воды
Q1
Что вы подразумеваете под термином «автопротолиз воды»? Каково значение этого?
Процесс самоионизации молекул воды с образованием ионов гидроксония и гидроксид-ионов известен как автопиролиз воды.

