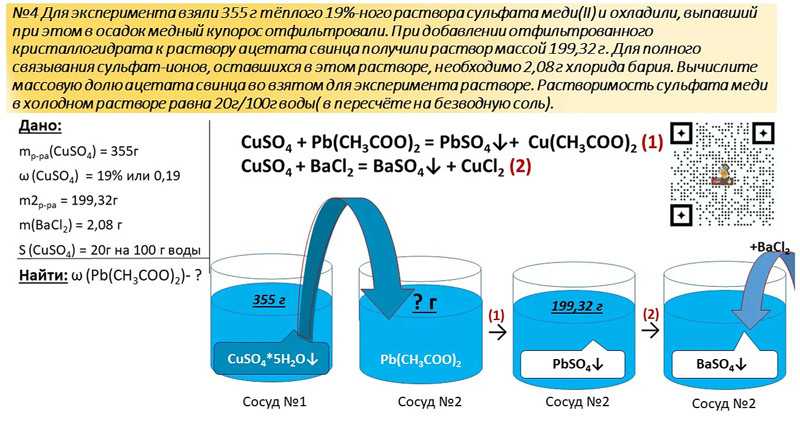
Как сделать медный купорос дома
В закладки
В этой статье я хочу рассказать как сделать медный купорос, но при этом не вдаваться в подробности, поскольку все эти методы и технологии уже рассказаны на сайте и данная статья будет обзорная со словами ссылками по которым можно будет перейти за нужную вам страницу. В общем суть получения этого химического вещества, в виде камня синего цвета сводится к растворению металлической меди или ее соединений в серной кислоте или как его называли в старину — купоросном масле и выделения его из водного раствора.
1-й способ заключается в растворении металлической меди в концентрированной серной кислоте при нагревании до 80-100 градусов. Он очень простой, но не экономичен из-за большой потери кислоты. Кроме того в ходе реакции происходит выделение окиси серы, которая очень опасна для людей и окружающей среды.
2-й способ состоит в том, через слой меди или медьсодержащего металла (латуни, бронзы), которые залиты сернокислотным электролитом, при нагревании 80 градусов
 Это хороший рецепт, но очень длительный.
Это хороший рецепт, но очень длительный.3-й способ получения CuSO4 состоит в том, что медный лом или чистый металл растворяется в азотной кислоте и получается нитрат меди, а при добавлении туда серной кислоты, которая отбирает у CuNO3 молекулу меди получается сульфат меди пятиводный и восстанавливается азотная кислота. При этом получается чистый продукт пятиводного сульфата меди, который имеет примесь азотной кислоты, которая легко убирается. Способ хороший и простой, но дорогой, по причине больших потерь азотки и опасен выделением оксида азота, который вреден для человека и окружающей среды.

5-й способ электролитический, относительно простой и быстрый, но при этом нужен источник постоянного тока, емкость для электролиза и полупроницаемая перегородка. При помощи тока медь растворяется в серной кислоте, а перегородка не дает раствору сульфата меди подойти вплотную к отрицательному электроду, на котором происходит разложение медного купороса на порошок меди и серную кислоту.
Категории: Применение сделанного своими руками
Комментарии (0)
Написать
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Похожие материалы:
Как приготовить раствор медного купороса?
24 апреля 2017 ditim Главная страница » Читаем Просмотров: 29,841
Раствор медного купороса активно применяют в садоводстве: это одновременно и фунгицид, и удобрение. Концентрация раствора зависит от цели применения. Так, например, для ранневесеннего опрыскивания деревьев готовят 1%-й раствор, а для полива почвы — 0,5%-й. Именно поэтому у садоводов часто возникают сомнения, как приготовить раствор медного купороса: 1, 2, 3, 5%-й. Но в начале разберемся с дозировками: когда какую применять. Это ОЧЕНЬ важно.
Концентрация раствора зависит от цели применения. Так, например, для ранневесеннего опрыскивания деревьев готовят 1%-й раствор, а для полива почвы — 0,5%-й. Именно поэтому у садоводов часто возникают сомнения, как приготовить раствор медного купороса: 1, 2, 3, 5%-й. Но в начале разберемся с дозировками: когда какую применять. Это ОЧЕНЬ важно.
3% — 5% раствор медного купороса
Дозировка: 300 — 500 г порошка медного купороса на 10 л воды.
«Выжигающий» раствор очень сильной концентрации. Опрыскивание им проводится в исключительных ситуациях, когда необходимо полное обеззараживание почвы и строительных объектов на участке. После такой обработки участок не рекомендуется использовать для сельскохозяйственных нужд как минимум 1 год.
0,5% — 1% раствор медного купороса
Дозировка: 50 — 100 г на 10 л воды
«Лечебно-профилактический» раствор эффективен против грибковых заболеваний, плесени и некоторых вредителей. Используется часто для опрыскивания деревьев и обработки ран на коре. Антракноз, клястероспориоз, коккомикоз, разные пятнистости и гнили, монилиоз, септориоз, филлостиктоз, парша, курчавость, плодовая гниль, черный рак.
Антракноз, клястероспориоз, коккомикоз, разные пятнистости и гнили, монилиоз, септориоз, филлостиктоз, парша, курчавость, плодовая гниль, черный рак.
1%-м раствором:
- Опрыскивают плодовые деревья и ягодные кустарники с целью профилактики грибковых заболеваний (весной до распускания почек).
- Перед посадкой выдерживают корни саженцев в растворе 3 минуты, а затем промывают чистой водой.
- Обрабатывают раны на коре плодовых деревьев летом.
0,5%-м раствором:
- Поливают почву ранней весной, чтобы не было фузариоза, гнили и черной ножки. Расход: 4 литра раствора на 1 м2.
- Обрабатывают раны на коре кустарников летом.
0,5% — 1% раствором:
- Проводят летнее опрыскивание деревьев и кустарников в саду при наличии симптомов ряда заболеваний:
Важно ! Опрыскивание нельзя осуществлять во время цветения. Для обработки лучше всего подходит сухая, безветренная погода. Температура воздуха — от +5 до +30 градусов. Время суток: утро или вечер. Время года: весна, лето, осень.
Время суток: утро или вечер. Время года: весна, лето, осень.
Раствор медного купороса для подкормки
Дозировка: 2-3 г или 20-30 г на 10 литров воды (внекорневая подкормка).
Для внекорневой подкормки растений используют очень слабый раствор медного купороса. Его применяют при наличии признаков недостатка меди, в том числе при хлорозе листьев, скручивании кончиков побегов, интенсивном образовании зелени без побегов и завязей. В качестве профилактики медного голодания раствор также будет эффективен. В справочнике «Удобрения и подкормки» (автор: О. Петросян) указана такая дозировка медного купороса для приготовления раствора:
Дозировка дана на одно 10-литровое ведро, для проведения летней внекорневой подкормки.
Но в этом же источнике сказано (цитата):
1%-й раствор применяют чаще всего, поэтому на его примере и посмотрим, как сделать раствор медного купороса.
Правила приготовления
Итак, готовим 1%-й раствор, а значит взять нужно 100 г на 10 литров воды. Если требуется сделать 3%-й раствор, то количество купороса увеличивается до 300 г на 10 литров воды.
Если требуется сделать 3%-й раствор, то количество купороса увеличивается до 300 г на 10 литров воды.
Как готовить:
- 100 г голубого порошка медного купороса высыпают в емкость.
- Заливают сначала малым количеством (примерно 500 мл) умеренно горячей воды. Температура воды должна быть около 50 градусов. В воде комнатной температуры вещество растворяется плохо, и раствор получается мутным.
- Порошку дают слегка раствориться, вращая емкость по кругу, оставляют немного постоять.
- Затем выливают оставшуюся воду (9,5 л) и хорошенько размешивают. Вода также должна быть горячей.
- Можно готовить раствор на водяной бане. Но категорически нельзя нагревать емкость прямо на плитке или газовой конфорке.
Правила безопасности
!!!!!!!
- Растворять медный купорос лучше всего в стеклянной, эмалированной или пластмассовой таре. Металлические (железные или оцинкованные) емкости брать нельзя — произойдет окисление.
- Нельзя готовить раствор купороса на кухне или вблизи пищевых продуктов. Лучше всего — выйти в огород и там разводить.
- Во время приготовления раствора стоит надеть перчатки и защитную маску, а при опрыскивании деревьев — накинуть полиэтиленовый плащик.
- При опрыскивании не должно быть рядом домашних животных, детей, людей.
- Необходимо избегать попадания раствора в глаза. А в случае попадания — срочно промыть их чистой водой.
- Недопустимо принимать раствор внутрь. Но если это случилось, рекомендуется выпить 2-3 сырых яйца или 300-500 мл молока и вызвать скорую помощь. Пить в большом количестве марганцовку или обычную воду бесполезно.
!!!!!!!
Купорос в составе бордосской жидкости
Популярное, проверенное временем средство для обработки плодовых деревьев и кустарников — бордосская жидкость. Ее готовят из медного купороса и гашеной извести-пушонки:
- Для ранневесеннего опрыскивания (до распускания почек) готовят 3%-й раствор: 300 г медного купороса и 225 г гашеной извести-пушонки на 10 литров воды.

- Летом применяют 1%-й раствор: 100 г медного купороса и 75-100 г гашеной извести пушонки на 10 литров воды.
Бордосская жидкость также эффективна против различных грибковых заболеваний, но менее агрессивна, нежели раствор только медного купороса. Известь нейтрализует, смягчает купорос. Подробно о приготовлении бордосской жидкости здесь.
Информация на упаковке от производителя
Метки: болезни, вредители, деревья, плодовые деревья, сад, средства
Сульфат меди – структура, свойства и применение CuSO4
Что такое сульфат меди?
Сульфат меди — это термин, который может относиться к любому из следующих химических соединений — сульфату меди (Cu 2 SO 4 ) или сульфату меди (CuSO 4 ). Однако последнее является предпочтительным соединением, описываемым термином «сульфат меди».
Наиболее распространенной формой сульфата меди является его пентагидрат, имеющий химическую формулу CuSO 4 .5H 2 O. Эта форма характеризуется ярко-синим цветом. Однако можно отметить, что безводная форма этой соли представляет собой порошок белого цвета.
Молекула CuSO 4 состоит из ионной связи между катионом меди (Cu 2+ ) и сульфатным анионом (SO 4 2- ). Иллюстрация, описывающая структуру молекулы сульфата меди, представлена ниже.
Сульфат меди можно получить обработкой металлической меди нагретой и концентрированной серной кислотой или обработкой оксидов меди разбавленной серной кислотой. Можно отметить, что степень окисления атома меди в молекуле CuSO
Свойства CuSO
4 В этом подразделе обсуждаются физические и химические свойства сульфата меди. Можно отметить, что свойства безводного CuSO 4 и CuSO 4 .5H 2 O значительно различаются и выделены отдельно.
Можно отметить, что свойства безводного CuSO 4 и CuSO 4 .5H 2 O значительно различаются и выделены отдельно.
Физические свойства
- Молярная масса безводной и пентагидратной форм сульфата меди составляет 159,609 г/моль и 249,685 г/моль соответственно.
- Безводный CuSO 4 имеет серо-белый порошкообразный вид, в то время как пентагидрат имеет ярко-синий цвет.
- Плотность безводной и пентагидратной форм составляет 3,6 г на кубический сантиметр и 2,286 г·см 9 .0023 -3
- Как гидратированные, так и безводные сульфаты меди склонны разлагаться при нагревании и, следовательно, не имеют точных температур кипения.
- Безводный CuSO 4 имеет орторомбическую кристаллическую структуру, тогда как кристаллы CuSO 4 .5H 2 O имеют триклинную структуру.
Химические свойства
- Ионы меди, присутствующие в сульфате меди, реагируют с ионами хлорида, принадлежащими концентрированной соляной кислоте, что приводит к образованию тетрахлоркупрата(II).

- Химическое уравнение для этой реакции имеет вид
- При нагревании до 650 o C CuSO 4 подвергается реакции разложения с образованием оксида меди (CuO) и SO 3 (триоксид серы).
- Сульфат меди хорошо растворим в воде со значениями растворимости 1,055 моляля и 1,502 моляля 10 o C и 30 o C соответственно.
Типичным примером одиночной реакции замещения, при которой один металл замещает другой, является реакция между железом и сульфатом меди, определяемая реакцией Fe + CuSO 4 → FeSO 4 + Cu
Использование сульфата меди
Базовые химические наборы, которые используются в качестве учебных пособий, обычно содержат сульфат меди. Химическое соединение CuSO 4 имеет широкий спектр применения. Некоторые из этих применений перечислены ниже.
- Пентагидрат этого соединения CuSO 4 .
 5H 2 O используется в качестве фунгицида из-за его способности убивать несколько грибков.
5H 2 O используется в качестве фунгицида из-за его способности убивать несколько грибков. - Сульфат меди используется в растворе Бенедикта и в растворе Фелинга, который используется при тестировании на восстанавливающие сахара.
- Он также используется для проверки образцов крови на наличие таких заболеваний, как анемия.
- CuSO 4 смешивается с KMnO 4 (перманганат калия) с образованием окислителя, который можно использовать при конверсии 1 или
- Также используется в качестве фиксатора красителя в процессе окрашивания овощей.
- Растворы медного купороса в воде можно использовать в качестве резистивного элемента жидких резисторов.
- Его также можно использовать в качестве декоративного элемента, так как он придает цвет цементу, керамике и другим металлам.
- Сульфат меди также добавляют в клеи для переплетных работ, чтобы защитить отпечатанную бумагу от насекомых.
Часто задаваемые вопросы
Для чего используется медный купорос?
Пентагидрат соединения, CuSO4. 5х3О используется как фунгицид, потому что он может уничтожить многие грибы. Сульфат меди используется в растворах Фелинга и Бенедикта. С помощью этого соединения образцы крови можно проверить на наличие таких состояний, как анемия.
5х3О используется как фунгицид, потому что он может уничтожить многие грибы. Сульфат меди используется в растворах Фелинга и Бенедикта. С помощью этого соединения образцы крови можно проверить на наличие таких состояний, как анемия.
Почему безводный сульфат меди белый, а пентагидрат синий?
В гидратированном CuSO4 молекулы воды, окружающие центральный металл (Cu), действуют как лиганды, что приводит к dd-переходу и, следовательно, излучению синего цвета в видимой области, из-за которого гидратированный CuSO4 кажется синим. Поскольку безводный CuSO4 не содержит кристаллизационной воды, он сохраняет свой белый цвет.
Сульфат меди твердый или водный?
Сульфат меди(II) представляет собой гидратированное твердое вещество голубого цвета, связанное с молекулами воды. Он становится беловатым в безводном состоянии, когда он не связан с водой на молекулярном уровне. Когда он гидратирован, к одной молекуле сульфата меди обычно присоединяется пять молекул воды. Нагревание CuSO4 обезвоживает его.
Нагревание CuSO4 обезвоживает его.
Из описанных выше применений можно понять, что сульфат меди является чрезвычайно важным химическим соединением, несмотря на его токсичность для человека. Чтобы узнать больше о CuSO 4 и другие важные химические соединения, такие как K 2 Cr 2 O 7 , зарегистрируйтесь в BYJU’S и загрузите мобильное приложение на свой смартфон.
Сульфат меди — MEL Chemistry
Реагенты
- Сульфат меди(II)
Безопасность
- Наденьте защитные перчатки и очки.
- Проведите эксперимент на пластиковом подносе.
- Соблюдайте меры предосторожности при работе с кипящей водой.

Общие правила безопасности
- Не допускайте попадания химических веществ в глаза или рот.
- Держите маленьких детей, животных и тех, кто не носит защитные очки, подальше от экспериментальной зоны.
- Храните этот экспериментальный набор в недоступном для детей младше 12 лет месте.
- Очистите все оборудование после использования.
- Убедитесь, что все контейнеры полностью закрыты и правильно хранятся после использования.
- Убедитесь, что все пустые контейнеры утилизированы надлежащим образом.
- Не используйте оборудование, которое не входит в комплект поставки или не рекомендовано в инструкции по эксплуатации.
- Не заменяйте продукты питания в оригинальной упаковке.
 Утилизируйте немедленно.
Утилизируйте немедленно.
Общая информация по оказанию первой помощи
- При попадании в глаза: Промыть глаза большим количеством воды, при необходимости держать глаза открытыми. Немедленно обратитесь за медицинской помощью.
- При проглатывании: прополоскать рот водой, выпить немного пресной воды. Не вызывает рвоту. Немедленно обратитесь за медицинской помощью.
- При вдыхании: Вынести пострадавшего на свежий воздух.
- При попадании на кожу и при ожогах: промыть пораженный участок большим количеством воды не менее 10 минут.
- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химикат и его контейнер.
- В случае травмы всегда обращайтесь за медицинской помощью.

Консультации для присматривающих за взрослыми
- Неправильное использование химикатов может привести к травмам и ущербу для здоровья. Проводите только те опыты, которые указаны в инструкции.
- Этот экспериментальный набор предназначен для использования только детьми старше 12 лет.
- Поскольку способности детей сильно различаются даже в пределах возрастных групп, наблюдающие взрослые должны проявлять осторожность в отношении того, какие эксперименты подходят и безопасны для них. Инструкции должны позволять наблюдателям оценивать любой эксперимент, чтобы установить его пригодность для конкретного ребенка.
- Перед началом экспериментов надзирающий взрослый должен обсудить предупреждения и информацию о безопасности с ребенком или детьми. Особое внимание следует уделять безопасному обращению с кислотами, щелочами и горючими жидкостями.

- Территория, окружающая эксперимент, должна быть свободна от каких-либо препятствий и вдали от места хранения продуктов питания. Она должна быть хорошо освещена и проветрена, а также находиться рядом с водопроводом. Должен быть обеспечен прочный стол с термостойкой столешницей.
- Вещества в одноразовой упаковке должны быть израсходованы (полностью) в течение одного эксперимента, т.е. после вскрытия упаковки.
Часто задаваемые вопросы и устранение неполадок
CuSO 4 не растворяется. Что я должен делать?
Сульфат меди в этих условиях не растворяется полностью, поэтому просто перелейте раствор в чашку Петри, оставив нерастворимый осадок.
Кристаллы растут очень медленно или совсем не растут.
Подожди еще немного — в конце концов ты получишь свои прекрасные кристаллы!
Мои кристаллы получились мелкими и невзрачными.
Возможно, это связано с тем, что они были загрязнены пылью или подвергались воздействию изменения температуры во время их формирования.
Но не расстраивайтесь! Вы можете изменить это. Подождите, пока кристаллы полностью не сформируются. Растворите те же кристаллы в 10 мл кипятка и снова перелейте в чашку Петри. Старайтесь оберегать раствор от пыли и перепадов температур.
Как сохранить кристаллы?
Если вы хотите, чтобы ваши кристаллы выглядели красиво, покройте их бесцветным лаком для ногтей. После того, как лак для ногтей высохнет, храните кристаллы в закрытом контейнере.
Вещество растворилось не полностью, и когда я налил раствор в чашку Петри, вместе с ним высыпался и осадок. Что я должен делать?
В этом случае слейте раствор обратно в пластиковый стаканчик и ополосните чашку Петри водой. Осторожно перелейте раствор обратно в чашку Петри, на этот раз без осадка.
Пошаговые инструкции
Растворите немного сульфата меди CuSO 4 в горячей воде.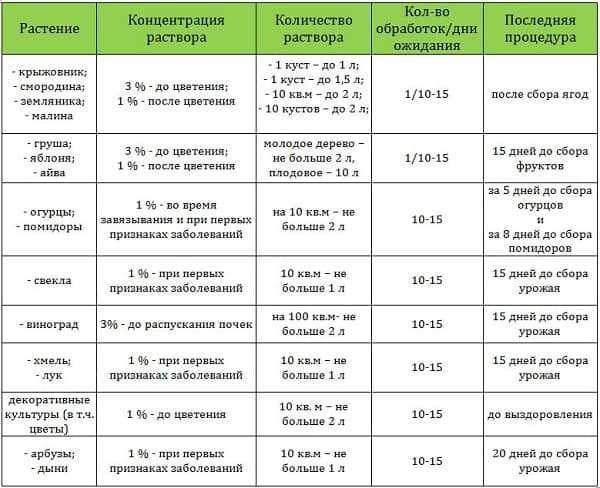 Сульфат меди гораздо лучше растворяется в горячей воде, чем в холодной, поэтому насыщенный раствор можно получить гораздо быстрее, используя тепло.
Сульфат меди гораздо лучше растворяется в горячей воде, чем в холодной, поэтому насыщенный раствор можно получить гораздо быстрее, используя тепло.
Оставьте раствор CuSO 4 остывать и испаряться.
Утилизация
ТБО утилизируйте вместе с бытовым мусором.
Научное описание
Образовавшиеся в этом эксперименте кристаллы обладают интересной особенностью — в их структуре помимо сульфата меди CuSO 4 присутствуют молекулы воды H 2 O . Как ни странно, в кристалле сульфата меди больше молекул воды, чем ионов Cu 2+ и SO 4 2-, в состав которых входит сульфат меди CuSO 4 — соотношение 5 молекул воды на одну CuSO 4 . Более того, именно наличие молекул воды придает этим кристаллам такой ярко-синий цвет.
Сульфат меди — не единственное соединение, которое образует эти «водянистые» кристаллы. На самом деле есть вещества, которые могут включать в себя несколько молекул воды на одну частицу самого вещества. Стиральная сода, или карбонат натрия Na 2 CO 3 , например, обычно содержит десять молекул воды на одну единицу Na 2 CO 3 . Химики называют такие вещества кристаллогидратами.
Почему растут кристаллы?
Медный купорос относится к тем веществам, которые лучше растворяются в воде при нагревании. Наоборот, их растворимость при охлаждении уменьшается, что в нашем случае приводит к выпадению сульфата меди в виде красивого голубого кристаллогидрата CuSO 4 ·5H 2 O. Так как раствор остывает медленно, кристаллы растут постепенно и могут стать довольно большими.
Подробнее
Почему раствор сульфата меди имеет тенденцию образовывать кристаллы, а не мелкий порошок? Кристаллы сильно отличаются от аморфных твердых тел (например, углерода или стекла): частицы, из которых они состоят, расположены в строгом геометрическом порядке. Хотя такая четкая комплементарная структура часто естественно неблагоприятна, частицы в кристаллических телах «чувствуют себя» вполне комфортно. Каждый атом сильно связан со своим окружением, и положительные заряды тесно взаимодействуют с отрицательными зарядами.
Хотя такая четкая комплементарная структура часто естественно неблагоприятна, частицы в кристаллических телах «чувствуют себя» вполне комфортно. Каждый атом сильно связан со своим окружением, и положительные заряды тесно взаимодействуют с отрицательными зарядами.
Последующие действия
Большой кристалл
Мелкие голубые кристаллы медного купороса, без сомнения, радуют глаз. А как насчет выращивания очень большого кристалла? Однако это не так просто.
В качестве емкости используйте пластиковый стаканчик (так его можно будет нагревать так же, как стакан с винной кислотой или сахаром в других опытах набора) или стеклянный стакан. В первом случае понадобится около 30 грамм медного купороса CuSO 4 *5H 2 O. Его можно найти в магазине, где продаются удобрения, или в хозяйственном магазине. Если вы решили вырастить очень крупный кристалл и сделать это в мензурке, приготовьте заранее 60-70 грамм медного купороса.
Полностью растворить медный купорос в горячей воде. Тщательно перемешайте раствор, пока не останется кристаллитов. В качестве «опоры» кристалла используйте кусок медной проволоки, нитку или занозу.
Пожалуйста, наберитесь терпения! Большой кристалл может расти несколько дней!
Кристаллизация в холодильнике
Как температура окружающей среды влияет на скорость и результат кристаллизации? Вы можете исследовать это! Повторите опыт, но приготовьте одновременно две пробирки с раствором медного купороса. В каждый из них вам нужно будет добавить по 5 граммов CuSO 4 *5H 2 O, поэтому используйте раствор и кристаллы из основного эксперимента.
Остановить после 9-го шага инструкции. Теперь поставьте одну из пробирок в чашку с горячей водой, как указано в шаге 10, а вторую поставьте в холодильник (температура внутри около 4 С или ).
Подождите 1-2 часа. Сравните результаты. Где кристалл стал больше? Где их больше и почему?
Кристаллы NaCl
Попробуйте вырастить кристалл самой обычной поваренной соли — хлорида натрия NaCl.
Растворить 39 г соли в 100 мл кипятка. Тщательно перемешайте раствор, пока не останется кристаллитов. В качестве «опоры» для кристалла лучше всего использовать нитку, намотанную на лучинку — опустите ее конец в раствор. Завяжите пару узлов на конце веревки — может поможет.
Теперь остается только ждать! Убедитесь, что стакан находится в таком месте, где его никто не тряхнет и не уронит.
Это интересно!
Зачем выращивать кристаллы?
Многие химики-синтетики открывают и используют в своей работе различные методы выращивания монокристаллов. Так чем же он привлекателен и выгоден для профессиональных химиков?
Помимо эстетического эффекта («Я синтезировал вещество, и оно образует прекрасные кристаллы!»), существует насущная потребность собрать молекулы новых или неизвестных веществ в идеально упорядоченные монокристаллы. Обычно после синтеза нового соединения химик должен уточнить (подтвердить) его молекулярную структуру. Пока он этого не сделает, никто в мировом научном сообществе не примет его открытия.
Пока он этого не сделает, никто в мировом научном сообществе не примет его открытия.
Существует множество косвенных методов исследования молекулярной структуры вещества. Например, химики могут подвергать вещество воздействию видимого или инфракрасного света, сильного магнитного поля или другой физической нагрузки, пытаясь понять, в каком порядке его атомы расположены внутри молекул.
Среди этих методов наиболее надежным и распространенным подходом к определению структуры нового соединения является так называемый рентгеноструктурный анализ. Это позволяет исследователям сделать «моментальный снимок» решетки нового вещества. Эта информация, в свою очередь, может сразу ответить на все вопросы о его молекулярном строении. Однако, несмотря на свою эффективность, этот метод имеет очень существенный недостаток: вещество необходимо анализировать в виде монокристалла.
Следует понимать, что каждая молекула, даже если речь идет об очень больших молекулах полимеров или белков, очень и очень мала, обнаружить которую можно только с помощью специального оборудования и в строгих условиях. Таким образом, раскрытие структуры одной молекулы требует дополнительной ловкости. Однако даже в миллиграмме любого вещества содержится огромное количество одинаковых молекул. Если предположить, что все молекулы одинаково реагируют на одно и то же внешнее воздействие, а затем суммировать все эти реакции, то обнаружение этого объемного сигнала станет намного проще.
Таким образом, раскрытие структуры одной молекулы требует дополнительной ловкости. Однако даже в миллиграмме любого вещества содержится огромное количество одинаковых молекул. Если предположить, что все молекулы одинаково реагируют на одно и то же внешнее воздействие, а затем суммировать все эти реакции, то обнаружение этого объемного сигнала станет намного проще.
Как упоминалось ранее, монокристаллы уникальны тем, что составляющие их «блоки» расположены в строго определенном повторяющемся порядке. Он позволяет суммировать реакции молекул на определенное воздействие, так как все они одинаково организованы в пространстве. Метод рентгеноструктурного анализа предполагает, что молекулы вещества реагируют на рентгеновское облучение. После того, как эти лучи достигают молекул вещества, они определенным образом меняют свое направление, которое зависит от расположения атомов в монокристалле.
Далее ученые анализируют узор, созданный дифрагированными лучами, чтобы определить, где в кристалле расположены атомы, вызвавшие такое изменение.
