Диаграмма состояния фреон -12 (r12; cCl2f2, Dichlorodifluoromethane)
T critical = 112.00 °C, p critical = 41.57600 Bar, v critical = 0.00179 m3/kg

Рисунок 4.12 – Диаграмма состояния фреон-12
Диаграмма состояния фреон -22 (r22; chClF2, Chlorodifluoromethane)
T critical = 96.00 °C, p critical = 49.77400 Bar, v critical = 0.00191 m3/kg
critical = 96.00 °C, p critical = 49.77400 Bar, v critical = 0.00191 m3/kg

Рисунок 4.13 – Диаграмма состояния фреон-22
4.3. Лабораторная работа № 3 Исследование работы сплит системы в режиме подогрева (теплового насоса)
Лабораторная работа дисциплины «Гидравлические машины и холодильная техника», продолжительность работы, 2 часа; самостоятельная подготовка, 2 часа
ЦЕЛЬ РАБОТЫ
Целью работы является экспериментальное исследование влияния внешних факторов при работе сплит-системы в режиме подогрева (теплового насоса), построение процессов изменения состояния рабочего тела в диаграмме состояния.
ТЕОРЕТИЧЕСКАЯ ОСНОВА
Сплит-системы бывают двух типов: системы, работающие только в режиме охлаждения; системы (рисунок 4.8), работающие в режиме охлаждения и режиме обогрева [6].
Схема сплит-системы, работающей в и режиме охлаждения, и в режиме обогрева несколько усложняется по сравнению со схемой, представленной на рисунок 4.8. Это связано, с тем, что при переходе с режима охлаждения на режим обогрева, установка начинает работать в качестве теплового насоса.
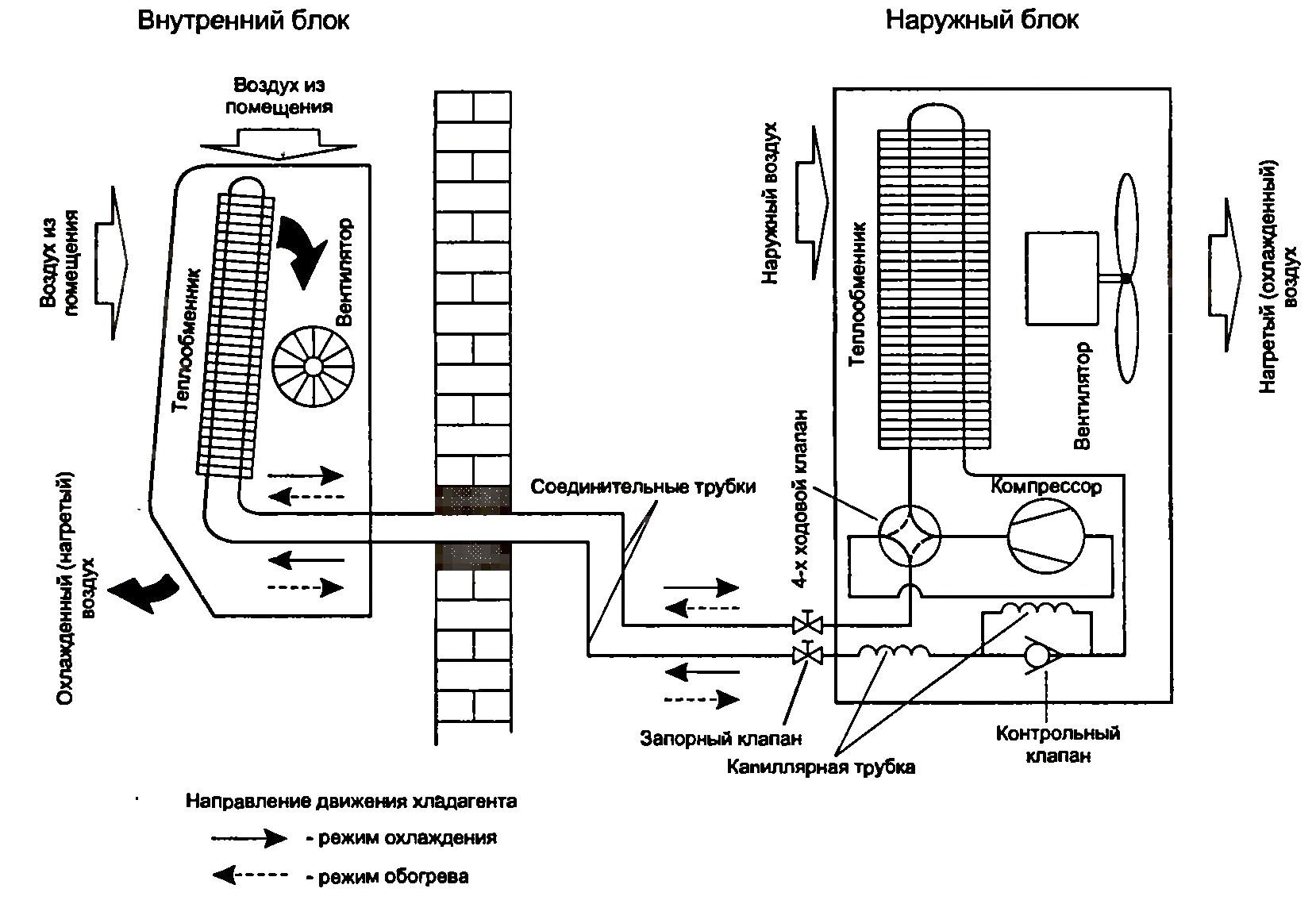
Реализация возможности перехода сплит-системы в режим работы в качестве теплового насоса (режим подогрева воздуха) обеспечивается контрольным клапаном. Контрольный клапан (четырехходовой), предназначен для изменения режима движения хладагента. Регулирование контрольного клапана осуществляется автоматически при переходе сплит-системы в режим подогрева.
С помощью 4-ходового контрольного клапана изменяется направление перекачивания компрессором хладагента. Этот клапан управляется соленоидом, на который от внутреннего блока подается напряжение питающей сети (220 В).
Принципиальная схема сплит-системы, работающей в режиме подогрева показана на рисунке 4.14.
 .
.
Рисунок 4.14 – Схема сплит-системы, работающей в режиме нагрева и охлаждения
При работе сплит-системы в режиме обогрева (теплового насоса) радиатор наружного блока охлаждается и на нём образуется большое количество конденсата. При установке сплит-системы не на фасаде здания (на лоджии, внутри строений) от внешнего блока требуется отвод конденсата.
Кроме того, работа сплит-системы в режиме теплового насоса ведет к интенсивному охлаждению конденсатора наружного блока и с возможностью его последующего обмерзания.
Так как средние температуры наружного воздуха на территории России достаточно низки (значительно ниже нуля), то эксплуатация сплит-систем в режиме подогрева имеет свои особенности.
При работе сплит-системы в режиме обогрева в условиях достаточно низких наружных температур происходит уменьшение вырабатываемой тепловой мощности при снижении температуры наружного воздуха.
Обогрев помещения с помощью сплит-системы используют осенью или весной, при положительной уличной температуре. При отрицательных температурах фреон не закипает в радиаторе внешнего блока, а в жидком виде поступает на вход компрессора и приводит к его поломке. Электроника качественных сплит-систем не позволит включить обогрев при низких уличных температурах.
Схемы и циклы тепловых насосов (ТН) аналогичны схемам и циклам холодильных машин. Но, если задачей холодильных установок является охлаждение тел или подержание температуры помещения на заданном низком уровне, то ТН предназначены для подвода теплоты, забираемой от источника с низкой температурой, к нагреваемому объекту при более высокой температуре. Происходит «передача» теплоты из холодного источника в горячий. Отсюда и название «тепловой насос».
Работа ТН состоит в следующем. За счет теплоты источника с низкой температурой в испарителе (И) (рисунок 4.9) происходит парообразование рабочего тела с низкой температурой кипения (фреон, аммиак и т. п.). Полученный пар поступает в компрессор (К), где повышаются давление и температура пара (процесс1-2, рисунок 4.10), далее пар направляется в охладитель (теплообменник) (О) (рисунок 4.9), где охлаждается и конденсируется, отдавая свою теплоту охлаждающей жидкости (газу, воздуху). Образовавшийся конденсат дросселируется редукционным вентилем (РВ) с уменьшением температуры и давления (процесс 3-4, рисунок 4.10).
При работе сплит-системы в режиме подогрева в качестве охлаждающей жидкости в охладителе используется воздух помещения, нагнетаемый вентилятором на теплообменник (рисунок 4.14).
Характеристикой совершенства работы ТН (сплит-системы, работающей в режиме обогрева) является отношение теплоты, отданной к потребителю (воздуху помещения), к затраченной при этом работе, т. е.
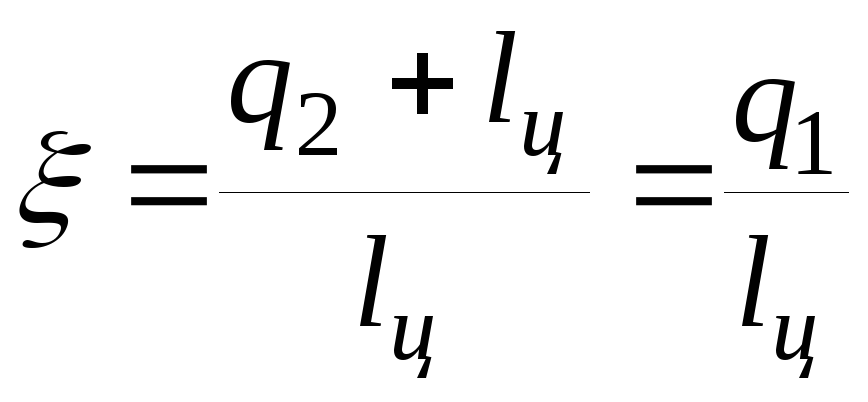 . (4.14)
. (4.14)
Коэффициент ξ называют отопительным коэффициентом или коэффициентом теплоиспользования, или коэффициентом преобразования ТН.
Коэффициент преобразования ТН можно выразить через холодильный коэффициент цикла:
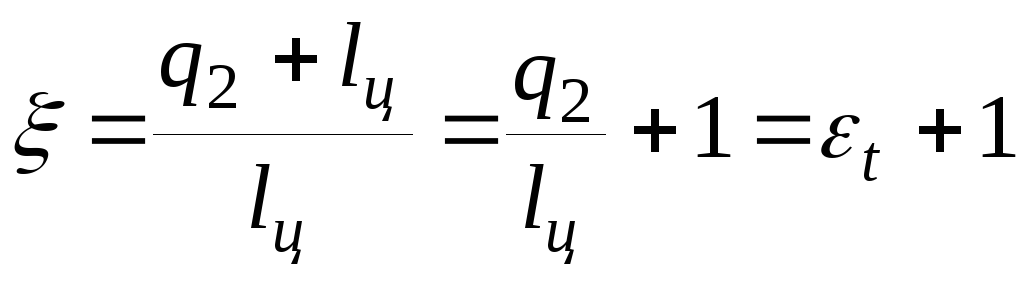 . (4.15)
. (4.15)
Если в ТН используется паровой цикл (рисунок 4.10), то коэффициент ξ равен:
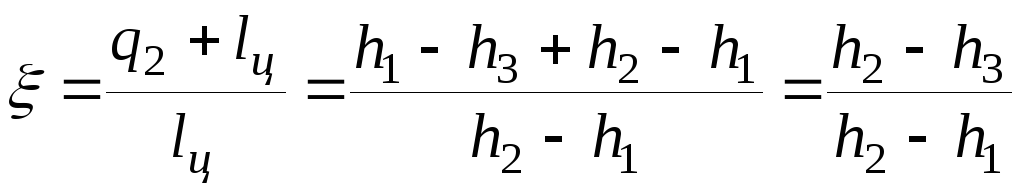 . (4.16)
. (4.16)
В случае возможности работы ТН по обратному циклу Карно (рисунок 4.11), коэффициент преобразования ξ определяется как:
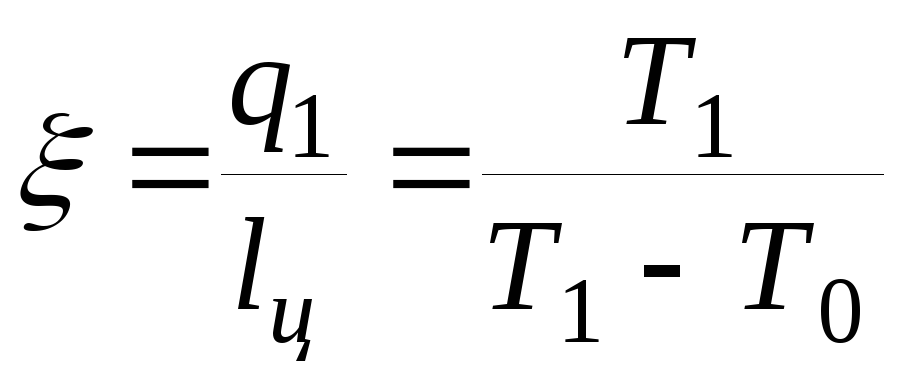 , (4.17)
, (4.17)
где Т1и Т0 – соответственно, температуры потребителя и источника теплоты, К.
ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА
Схема экспериментальной установки представлена на рисунке 4.14.
В наружном блоке, находящемся вне помещения, имеется компрессор, осуществляющий циркуляцию хладагента в системе. Сплит-система приводится в режим обогрева помещения (режим ТН). Четырехходовой контрольный клапан (рисунок 4.14) меняет направление движения хладагента в контуре. Компрессор подает хладагент из внешнего блока (рисунок 4.14) во внутренний. Рабочее тело (газ) с высокой температурой и давление поступает во внутренний теплообменник, где конденсируется, отдавая тепло воздуху, нагнетаемому вентилятором из помещения. Сконденсированный хладагент дросселируется, направляется во внешний блок, где воспринимает тепло от воздуха окружающей среды, подаваемый на теплообменник внешнего блока.
5.1.1. Диаграммы холодильных агентов | Промышленные холодильные установки
Эксплуатация холодильной установки невозможна без правильного понимания термодинамических процессов, происходящих в ней. Изучение отдельных процессов, входящих в цикл паровой компрессионной машины, а также связи между ними, их взаимного влияния друг на друга может быть значительно упрощено при использовании термодинамических диаграмм холодильных агентов. Умение пользоваться диаграммами необходимо также для контроля и анализа параметров действующих холодильных установок; настройки приборов автоматического контроля и регулирования; расчета и подбора холодильного оборудования при реконструкции и расширении действующих установок.
Для каждого холодильного агента существуют свои диаграммы, но принцип их построения и пользования ими одинаков. На рис. 53, 54, 55 приведены диаграммы для аммиака и хладонов R-12 и R-22. Наиболее часто применяемыми являются диаграмма энтальпия-давление (l — lgP диаграмма) и диаграмма энтропия-температура (S — T диаграмма), из которых диаграмма энтальпия-давление наиболее удобна, и именно она будет рассматриваться в дальнейшем.
Искусственное охлаждение в паровых холодильных машинах основано на процессе кипения холодильных агентов при низких температурах, в результате чего они переходят из жидкого состояния в пар, поглощая определенное количество теплоты. Чтобы процесс искусственного охлаждения был замкнутым и повторяющимся, пар холодильного агента сжимается, а затем конденсируется путем охлаждения. Таким образом, в холодильной машине происходят два процесса фазового перехода хладагента: из жидкости в пар — кипение и из пара в жидкость — конденсация. Эти два процесса и отражены на всех диаграммах. На рис. 56-а показано, что диаграмма разделена на три зоны, отделенные друг от друга кривыми насыщенной жидкости и насыщенного пара.
Зона переохлажденной жидкости означает, что в любой точке этой зоны хладагент находится в жидком состоянии при температуре ниже температуры насыщения при соответствующем давлении.
Зона влажного пара соответствует процессам перехода из жидкости в пар или из пара в жидкость. В любом случае хладагент представлен в виде парожидкостной смеси, называемой влажным паром. Таким образом, влажный пар — это смесь насыщенной жидкости и насыщенного пара, которая находится либо в состоянии кипения, либо в состоянии конденсации. Температура смеси насыщенных пара и жидкости одинакова и называется температурой насыщения при определенном давлении насыщения.
Зона перегретого пара отражает состояние пара, температура которого выше температуры насыщения при соответствующем Р.
На пограничных кривых насыщенных жидкости или пара хладагент имеет параметры насыщения, но при этом представляет собой уже однородную фазу, т. е. либо жидкость, либо пар.
При эксплуатации очень важно отличать по показаниям контрольно-измерительных приборов переохлажденную жидкость от насыщенной, а перегретый пар — от влажного или насыщенного пара, так как от этого зависят эффективность и безопасность работы установки. При одном и том же P насыщенная жидкость, влажный пар и насыщенный пар имеют одинаковую t, переохлажденная жидкость — более низкую, а перегретый пар — более высокую t. Таким образом, показания манометров при всех перечисленных состояниях будут одинаковые, а термометров — разные.
Диаграмма энтальпия-давление отражает шесть параметров холодильного агента, которые изображены в виде различных линий (рис. 56, б). Цифровые значения основных параметров даны в удельных величинах, т. е. отнесенные к 1 кг хладагента, и проставлены на поле диаграммы над соответствующими кривыми.
Линии постоянных паросодержаний проходят только в области влажного пара. Паросодержание обозначается символом х.
Линии постоянных давлений — изобары — проходят через все зоны горизонтально. Логарифмический масштаб в изображении изобар применен из-за неравномерности шкалы давлений в области вакуума и избыточного давления. Величина абсолютного давления в Па•105 или в МПа, проставленная на вертикальной шкале слева диаграммы, обозначается символом Р.
Линии постоянных температур — изотермы — в области переохлаждения проходят почти вертикально, в области влажного пара — горизонтально. Здесь изотермы совпадают с изобарами, так как фазовое состояние хладагент меняет при постоянных значениях t и Р. В зоне перегретого пара изотермы идут наклонно вниз. Значения t в °С расположены рядом с кривыми постоянной температуры в зонах переохлаждения и перегрева, а также на кривых насыщенной жидкости и пара.
Линии постоянных удельных энтальпий (постоянных теплосодержаний) проходят вертикально. Удельной энтальпией называют полную энергию 1 кг рабочего тела, равную сумме удельной внутренней энергии и потенциальной энергии давления. Важно отметить, что в термодинамическом процессе при постоянном Р изменение удельной энтальпии равно удельному количеству подведенной теплоты. Это положение является основой тепловых расчетов холодильного оборудования. Значения удельной энтальпии в кДж/кг проставлены на горизонтальной шкале внизу и вверху диаграммы и обозначены символом i.
Линии постоянных удельных объемов — изохоры — обозначены прерывистыми кривыми, проходящими в областях влажного и перегретого пара. В области жидкости изохоры не нанесены из-за слишком малого объема жидкости по сравнению с объемом пара, что трудно показать в масштабе диаграммы. Поэтому удельный объем жидкого хладагента по диаграмме не определяется. Его можно определить по таблице насыщенных паров хладагента. Значения удельных объемов в м3/кг проставлены в зонах влажного и перегретого пара над соответствующими кривыми и обозначены символом v.
Линии постоянных удельных энтропии — адиабаты — проходят через поле диаграммы по диагонали. Энтропия — функция состояния термодинамической системы, характеризующая направление протекания процесса теплообмена между системой и внешней средой. Значение энтропии в кДж/(кг•К) приведены над соответствующими кривыми и обозначены символом S.
Каждой точке на поле диаграммы соответствует состояние хладагента со строго определенными параметрами. Если две точки соединить линией, то она укажет на характер процесса, протекающего между двумя состояниями. В некоторых диаграммах холодильных агентов средняя часть диаграммы в области влажного пара может быть опущена, так как параметры хладагентов в этой зоне не представляют интереса для анализа и расчетов холодильных установок.
Диаграммы | Холод-проект — Проектирование Холодильных Систем
Диаграммы
В настоящем разделе нашего сайта можно просмотреть и скачать диаграммы приведенных ниже хладагентов в форматах *.png и *.pdf.
Условные сокращения в тексте
CFC – chlorofluorocarbon ХФУ – хлорфторуглеродные
HCFC – hydrochlorofluorocarbons ГХФУ – гидрохлорфторуглеродные
HFC – hydrofluorocarbons ГФУ – гидрофторуглеродные
Таблица 1
Озоноразрушающие | Промежуточные (переходные) | Озонобезопасные | Природные хладагенты (безгалоидные) | |||
Синтетические | ||||||
CFC(ХФУ) | HCFC(ГХФУ) | HFC(ГФУ) | ||||
Однокомпонентные и смесевые | Однокомпонентные и смесевые | Смесевые | Однокомпонентные | Смесевые | Название вещества | Обозначение |
R11 | R21 | R401A | R23 | R404A | Метан | R50 |
R12 | R22 | R401B | R134a | R407A | Этан | R170 |
R13 | R123 | R401C | R152a | R407B | Пропан | R290 |
R113 | R502 | R402A | RC318 | R407C | Бутан | R600 |
R114 | R402B | R410A | Изобутан | R600a | ||
R500 | R406A | R507 | Аммиак | R717 | ||
R408A | R508A | Вода | R718 | |||
R409A | Азот | R728 | ||||
| Воздух | R729 | |||||
| Кислород | R732 | |||||
| Аргон | R740 | |||||
| Диоксид углерода | R744 | |||||
| Этилен | R1150 | |||||
| Пропилен | R1270 | |||||
Диаграмма “концентрация-энтальпия” водоаммиачного раствора (.JPG, 3 МБ, 4074 × 6688)
На сегодняшний день в мире использование ХФУ хладагентов запрещено ввиду высокого озоноразрушающего потенциала.
Еще в начале 1980-х годов учёные во всем мире начали предупреждать общественность о вредном воздействии хлорфторуглеродов (CFC) на окружающую среду. Это дало толчок к разработке, и в последствии к развитию и широкому промышленному производству менее вредных хладагентов – фторхлорсодержащих углеводородам (HCFC) и фторуглеводородов (HFC).
Так с 01.01.1996 г. было запрещено производство R11 и R12 хладагентов.
Монреальский протокол предусматривает принудительное введение с 2004 года глобального графика постепенного прекращения использования хладагентов HCFC (таких как R22). Хладагент R22 и другие хладагенты HCFC будут полностью запрещены к 2020 году.
Необходимо добавить к вышесказанному, что во многих документах более ранних годов издания, использующихся для обучения студентов в ВУЗах, и других учебных заведениях, методических и других материалах в качестве примеров расчетов приведены как альтернативные хладагенты (в том числе хладагенты для средне- и долгосрочной перспективы – HFC (ГФУ) – хлор-несодержащие и природные хладагенты (безгалоидные)), так и устаревшие озоноразрушающие CFC (ХФУ) и HCFC (ГХФУ) хладагенты. А также в установках с длительными сроками эксплуатации могут до сих пор использоваться “устаревшие” хладагенты. Ввиду вышесказанного в данном разделе мы сочли целесообразным привести их диаграммы.
Более развернутый перечень хладагентов их химического состава и физических свойств приведен на нашем сайте в статье Основные параметры холодильных агентов
Поделитесь с друзьями
Хладагент R12: описание и свойства
Хладагент R12 — это бесцветный газ без запаха.
Химическое название R12 — ДиФторДиХлорМетан.
Запрет на производство — с 1 января 1996 года (согласно измененной редакции Монреальского протокола на конференции в Копенгагене, ноябрь, 1992г.).
Физические свойства R12
Применение R12
Хладагент R12 применяется в холодильных установках и агрегатах промышленного и бытового назначения и промышленных кондиционерах, газовый диэлектрик, пропеллент (в смеси с фтортрихлорметаном), порообразователь при получении пенопластов, растворитель, среда для химических процессов, реагент для химических синтезов, индикатор утечек при проверке герметичности оборудования.
Экологические характеристики и пожароопасность R12
ODP=0.9, HGWP=3.1, GWP=8500, ПДК=3000 мг/м3. Класс опасности 4.
При соприкосновении с пламенем и горячими поверхностями разлагается с образованием высокотоксичных продуктов.
Негорючий газ. Флегматизирует горение углеводородов. Минимальная гасящая объемная концентрация при горении углеводородов в воздухе 14.9%.
Термическая стабильность R12
Термическое разложение при времени контакта 1-10с начинается: в трубе из стали 12X18h20T при 520°С, из никеля Н-1 при 580°С; при времени контакта 4сут в присутствии стали, меди и масла ХФ12-18 при 120°С.
Лабораторный способ получения R12
Взаимодействие тетрахлорметана и фтороводорода в присутствии хлорида сурьмы(V).
Промышленное производство R12
В промышленности получают совместно с фтортрихлорметаном жидкофазным фторированием тетрахлорметана фтороводородом в присутствии катализатора фторида сурьмы(V), а также газофазным методом.
Транспортировка и хранение R12
Заливают в железнодорожные цистерны и баллоны, а также в бочки, контейнеры и другие сосуды, рассчитанные на давление 1.2МПа. Коэффициент заполнения 1.1 кг продукта на 1 дм3 вместимости сосуда. Перевозят любым видом транспорта. Хранят в закрытых складских помещениях или под навесом.
Характеристики R12 на линии насыщения
Комментарии
Структура основных видов диаграмм хладагентов, используемых в холодильной технике | Холод-проект
Диаграммы p-h, log(p)–h, T-s, h-s используются для построения циклов холодильных машин, в зависимости от используемого хладагента, а также для определения свойств вещества в заданной точке цикла
Диаграммы p-h, log(p)–h отличаются масштабом оси давления: в одном случае – это p, в другом – lg p.
Диаграмма log(p)–h
На рисунке 1 показано схематическое изображение диаграммы log(p)–h. В центре диаграммы расположена в виде перевернутой буквы U линия насыщенной жидкости, верхняя точка которой является критической. Эта линия разделяет диаграмму на 3 диапазона. В диапазоне (1) хладагент находится в жидкой фазе, в диапазоне (2) в парожидкостной (двухфазное состояние), в диапазоне (3) в фазе перегретого пара.
По такому же принципу построены T-s и h-s диаграммы – линия насыщенной жидкости делит диаграмму на 3 диапазона.
Рисунок 1 – Схематическое изображение диаграммы log(p)–h
По оси абсцисс диаграммы откладывается удельная энтальпия h, кДж/кг
По оси ординат, которая представляет собой логарифмическую шкалу, нанесено значение давления p, Бар
Красными линиями (T=const) показаны изотермы – линии постоянной температуры Т, т.е. вдоль изотермы температура вещества остается постоянной. Единицы измерения температуры на диаграмме °С. Примечательно, что изотермы внутри диапазона (2) парожидкостной смеси – прямые, а за линией насыщения они принимают траекторию кривых.
Синими линиями (s=const) показаны изоэнтропы – линии постоянной энтропии s, т.е. вдоль изоэнтропы энтропия вещества остается постоянной. Единицы измерения энтропии на диаграмме Дж/(кг•K).
Зелеными линиями (v=const) показаны изохоры – постоянного удельного объема v, т.е. вдоль изохоры удельный объем вещества остается постоянным. Единицы измерения удельного объема на диаграмме м³/кг.
Также на диаграмме тонкими линиями черного цвета (x=const) внутри диапазона (2) проходят линии постоянной сухости x, показывающие процентное содержание пара в смеси. Линия x = 0,1 соответствует состоянию газа с 10% содержанием пара и 90-% содержанием жидкости. Кривые x = 0 и x = 1 являются пограничными линиями. Линия х = 0 – это линия жидкого хладагента, а линия х = 1 – это линия пара.
Диаграмма T-s
Рисунок 2 – Схематическое изображение диаграммы T-s
По оси абсцисс диаграммы откладывается энтропия s, Дж/(кг•K)
По оси ординат нанесено значение давления температуры T, °С
Красными линиями (p=const) показаны изобары – линии постоянного давления p, т.е. вдоль изобары давление вещества остается постоянным. Единицы измерения давления на диаграмме бар. Примечательно, что изобары внутри диапазона (2) парожидкостной смеси – прямые, а за линией насыщения они принимают траекторию кривых.
Синими линиями (h=const) показаны изоэнтальпы – линии постоянной энтальпии h, т.е. вдоль изоэнтальпы энтальпия вещества остается постоянной. Единицы измерения энтальпии на диаграмме кДж/кг.
Также как и на диаграмме log(p)–h, на диаграммах T-s и h-s зелеными линиями (v=const), показаны изохоры, а тонкими линиями черного цвета (x=const) – линии постоянной сухости (описание см. выше – описание диаграммы log(p)–h).
Диаграмма h-s
Рисунок 3 – Схематическое изображение диаграммы h-s
По оси абсцисс диаграммы откладывается энтропия s, Дж/(кг•K)
По оси ординат диаграммы откладывается удельная энтальпия h, кДж/кг
Синими линиями (p=const) показаны изобары.
Красными линиями (T=const) показаны изотермы.
Таблица 1
Наименование параметра диаграммы | Наименование направления или пример графического изображения | ||
Диаграмма log(p)–h | Диаграмма T-s | Диаграмма h-s | |
h=const | Ось абсцисс | ——h=450— | Ось ординат |
p=const | Ось ординат | ——80—— | ——p=5,0— |
T=const | ——100—— | Ось ординат | ——100—— |
s=const | ——s=1,85— | Ось абсцисс | |
v=const | ———v=0,015—— | ||
x=const | ———x=0,10—— | ||
Поделитесь с друзьями
H, s-диаграмма — Википедия
Материал из Википедии — свободной энциклопедии
H, s-диагра́мма (чит. «аш-эс-диаграмма») (написание строчными буквами: «h, s-диаграмма», ранее i, s-диаграмма, также — диаграмма Молье) — диаграмма теплофизических свойств жидкости и газа (в основном воды и водяного пара), показывающая характер изменения различных свойств, в зависимости от параметров состояния. В основном большое применение получили h, s-диаграммы воды и водяного пара, так как в качестве рабочего тела в теплотехнике чаще всего применяются именно вода и водяной пар, из-за их сравнительной дешевизны и доступности, причём наиболее пристальное внимание оказывается именно той части диаграммы, в которой вода в парообразном состоянии, так как в жидком состоянии она практически несжимаема.
При проведении технико-экономических расчётов для подбора оборудования в теплоэнергетике и других отраслях и моделирования тепловых процессов необходимы надёжные проверенные данные о теплофизических свойствах воды и водяного пара в широкой области давлений и температур.
Многолетнее международное сотрудничество в области исследования свойств воды и водяного пара позволило разработать и внедрить международные нормативные материалы, содержащие уравнения для описания различных свойств, в специальные таблицы. На основании этих уравнений, соответствующих требованиям Международной системы уравнений для научного и общего применения (The IFC Formulation for Scientific and Generale Use), были составлены и опубликованы подробные таблицы теплофизических свойств воды и водяного пара, которые широко применяются в практике инженерных теплотехнических расчётов. Данные, полученные путём расчёта по международным уравнениям, были приняты и в СССР и получили определение таблиц термодинамических свойств воды и водяного пара. В них также включили данные по динамической вязкости.
Ещё в 1904 году немецкий теплофизик Рихард Молье разработал специальную диаграмму для упрощения и облегчения решений практических задач по теплотехнике, в которой в координатах энтальпии (h{\displaystyle h}) и энтропии (s{\displaystyle s}) графически отображаются сведения из таблиц состояний. В 1906 году в Берлине была издана его книга «Новые таблицы и диаграммы для водяного пара». Впоследствии такая диаграмма получила название Диаграмма Молье. В СССР некоторое время было принято название i, s-диаграмма, а в настоящее время — h, s-диаграмма.
Структура h, s-диаграммыH, s-диаграммы чаще всего содержат в себе данные о свойствах воды в жидком и газообразном состояниях, так как они представляют наибольший интерес с точки зрения теплотехники.
- Степень сухости — это параметр, показывающий массовую долю насыщенного пара в смеси воды и водяного пара. Значение x=0{\displaystyle x=0} соответствует воде в момент кипения (насыщения). Значение x=1{\displaystyle x=1}, показывает, что в смеси присутствует только пар. При нанесении соответствующих точек в координатах (h,s){\displaystyle (h,s)}, взятых из таблиц насыщения справочников свойств воды и водяного пара, при их соединении получаются кривые, соответствующие определённым степеням сухости. В таком случае линия x=0{\displaystyle x=0} является нижней пограничной кривой, а x=1{\displaystyle x=1} — верхней пограничной кривой. Область, заключённая между этими кривыми, является областью влажного пара. Область ниже кривой x=0{\displaystyle x=0}, которая стягивается практически в прямую линию (не показана), соответствует воде. Область выше кривой x=1{\displaystyle x=1} соответствует состоянию перегретого пара.
- Критическая точка (К). При определённом, достаточно высоком давлении, называемом критическим, свойства воды и пара становятся идентичными. То есть исчезают физические различия между жидким и газообразным состояниями вещества. Такое состояние называют критическим состоянием вещества, которому соответствует положение критической точки. Следует заметить, что она на пограничной кривой лежит гораздо левее максимума этой кривой.
- Изотерма — изолиния, построенная методом объединения точек по значениям энтальпии и энтропии, соответствующих определённой температуре. Изотермы пересекают пограничные кривые с изломом и, по мере удаления от верхней пограничной кривой, асимптотически приближаются к горизонтали. На схеме для упрощения представлены только три изотермы:
- t+Δt{\displaystyle t+\Delta t}
- t{\displaystyle t}
- t−Δt{\displaystyle t-\Delta t}
- Изобара — изолиния, построенная методом объединения точек по значениям энтальпии и энтропии, соответствующих определённому давлению. Изобары не имеют изломов при пересечении пограничных кривых. На схеме представлены только три изобары:
- p+Δp{\displaystyle p+\Delta p}
- p{\displaystyle p}
- p−Δp{\displaystyle p-\Delta p}
- Изохора — изолиния, построенная методом объединения точек по значениям энтальпии и энтропии, соответствующих определённому объёму. Изохоры на h, s-диаграмме в области перегретого пара, всегда проходит круче, чем изобары, и это облегчает их распознавание на одноцветных диаграммах. Построение изохор требует более кропотливой работы с таблицей состояний. На схеме представлены только три изохоры:
- v−Δv{\displaystyle v-\Delta v}
- v{\displaystyle v}
- v+Δv{\displaystyle v+\Delta v}
Изотермы и изобары в области влажного пара совпадают по причине линейной зависимости в состоянии насыщения.
H, s-диаграммы используют для расчёта систем испарительного охлаждения (с градирнями или брызгальными бассейнами) и систем кондиционирования воздуха. По диаграмме можно определить соотношение относительной и абсолютной влажности воздуха при разных температурах, точку росы, а также рассчитать необходимую степень насыщения воздуха влагой для достижения желаемой температуры.
С развитием современной электронно-вычислительной техники и появлением доступных компьютеров и приложений, большое распространение получили h, s-диаграммы в электронном виде. Такие диаграммы представляют собой обычный оконный интерфейс с полями для ввода исходных данных, графическими функциональными клавишами, и полем ответов. После ввода имеющихся данных, нажатием графической клавиши «Расчёт» или «Ввод» на клавиатуре компьютера можно вызвать необходимую информацию при условии соблюдения введённых параметров.
- Александров А.А. ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА РАБОЧИХ ВЕЩЕСТВ ТЕПЛОЭНЕРГЕТИКИ / А.А. Александров, К.А. Орлов, В.Ф Очков. — 2-е изд., перераб. и допол. — М.: Издательский дом МЭИ. 2017. — 226 [8] с.: ил. — сайт справочника http://twt.mpei.ac.ru/rbtpp
- Таблицы теплофизических свойств воды и водяного пара: Справочник. Рек. Гос.службой стандартных справочных данных. ГСССД Р-776-98 / А.А. Александров, Б.А. Григорьев — М.: Издательство МЭИ. 1999. ISBN 5-7046-0397-1.
- Теплоэнергетика и теплотехника. Книга вторая: «Теоретические основы теплотехники. Теплотехнический эксперимент. Справочник». / Под общей ред. В. А. Григорьева и В. М. Зорина — Москва. Энергоатомиздат. 1988 год. ISBN 5-283-00112-1
- Теоретические основы теплотехники: Учеб. пособие. 2-е изд., стер. / Ляшков В. И. — Москва: Изд-во Машиностроение-1, 2005 год. ISBN 5-94275-027-0
I-d диаграмма для начинающих (ID диаграмма состояния влажного воздуха для чайников)
После прочтения данной статьи, рекомендую прочитать статью про энтальпию, скрытую холодопроизводительность и определение количества конденсата, образующегося в системах кондиционирования и осушения: http://mrcynognathus.livejournal.com/7758.html
Доброго времени суток уважаемые начинающие коллеги!
В самом начале своего профессионального пути я наткнулся на данную диаграмму. При первом взгляде она может показаться страшноватой, но если разобраться в главных принципах, по которым она работает, то можно её и полюбить :D. В быту она называется и-д диаграмма.
В данной статье я попытаюсь просто(на пальцах) объяснить основные моменты, чтобы вы потом отталкиваясь от полученного фундамента самостоятельно углубились в данную паутину характеристик воздуха.
Примерно так она выглядит в учебниках. Как-то жутковато становится.
(для увеличения рисунка необходимо щелкнуть и потом еще раз щелкнуть по нему)
Я уберу все то лишнее, что не будет мне нужным для моего объяснения и представлю и-д диаграмму в таком виде:
(для увеличения рисунка необходимо щелкнуть и потом еще раз щелкнуть по нему)
Все равно еще не совсем понятно, что это такое. Разберем её на 4 элемента:
Первый элемент – влагосодержание (D или d). Но прежде чем я начну разговор об влажности воздуха в целом, я бы хотел кое о чем с вами договориться.
Давайте договоримся “на берегу” сразу об одном понятии. Избавимся от одного прочно засевшего в нас (по крайней мере, в меня) стереотипа о том, что такое пар. С самого детства мне показывали на кипящую кастрюлю или чайник и говорили, тыкая пальцем на валящий из сосуда “дым”: “ Смотри! Вот это пар”. Но как многие, дружащие с физикой люди, мы должны понимать, что “Водяной пар — газообразное состояние воды. Не имеет цвета, вкуса и запаха”. Это всего лишь, молекулы h3O в газообразном состоянии, которых не видно. А то что мы видим, валящее из чайника – это смесь воды в газообразном состоянии(пар) и “капелек воды в пограничном состоянии между жидкостью и газом”, вернее видим мы последнее (так же, с оговорками, можно назвать то что мы видим — туманом). В итоге мы получаем, что в данный момент, вокруг каждого из нас находится сухой воздух (смесь кислорода, азота…) и пар (h3O).
Так вот, влагосодержание говорит нам о том, сколько этого пара присутствует в воздухе. На большинстве и-д диаграмм данная величина измеряется в [г/кг], т.е. сколько грамм пара(h3O в газообразном состоянии) находится в одном килограмме воздуха (1 кубический метр воздуха в вашей квартире весит около 1,2 килограмма). В вашей квартире для комфортных условий в 1 килограмме воздуха должно быть 7-8 грамм пара.
На и-д диаграмме влагосодержание изображается вертикальными линиями, а информация о градации расположена в нижней части диаграммы:
(для увеличения рисунка необходимо щелкнуть и потом еще раз щелкнуть по нему)
Второй важный для понимания элемент – температура воздуха (T или t). Думаю здесь ничего объяснять не нужно. На большинстве и-д диаграмм данная величина измеряется в градусах Цельсия [°C]. На и-д диаграмме температура изображается наклонными линиями, а информация о градации расположена в левой части диаграммы:
Третий элемент ИД-диаграммы – относительная влажность (φ). Относительная влажность, это как раз та влажность, о которой мы слышим из телевизоров и радио, когда слушаем прогноз погоды. Измеряется она в процентах [%].
Возникает резонный вопрос: “Чем отличается относительная влажность от влагосодержания?” На данный вопрос я отвечу поэтапно:
Первый этап:
Воздух способен вмещать в себя определенное количество пара. У воздуха есть определенная “паровая грузоподъемность”. Например, в вашей комнате килограмм воздуха может “взять на свой борт” не больше 15 грамм пара.
Предположим, что в вашей комнате комфортно, и в каждом килограмме воздуха, находящегося в вашей комнате, имеется по 8 грамм пара, а вместить каждый килограмм воздуха в себя может по 15 грамм пара. В итоге мы получаем, что в воздухе находится 53,3% пара от максимально возможного, т.е. относительная влажность воздуха — 53,3%.

Второй этап:
Вместимость воздуха различна при разных температурах. Чем выше температура воздуха, тем больше пара он может в себя вместить, чем ниже температура, тем меньше вместимость.
Предположим, что мы нагрели воздух в вашей комнате обычным нагревателем с +20 градусов до +30 градусов, но при этом количество пара в каждом килограмме воздуха осталось прежним – по 8 грамм. При +30 градусах воздух может “взять себе на борт” до 27 грамм пара, в итоге в нашем нагретом воздухе – 29,6% пара от максимально возможного, т.е. относительная влажность воздуха — 29,6%.
Тоже самое и с охлаждением. Если мы охладим воздух до +11 градусов, то мы получим “грузоподъемность” равную 8,2 грамм пара на килограмм воздуха и относительную влажность равную 97,6%.
Заметим, что влаги в воздухе было одинаковое количество – 8 грамм, а относительная влажность прыгала от 29,6% до 97,6%. Происходило это из-за скачков температуры.
Когда вы зимой слышите о погоде по радио, где говорят, что на улице минус 20 градусов и влажность 80%, то это значит, что в воздухе около 0,3 граммов пара. Попадая к вам в квартиру этот воздух нагревается до +20 и относительная влажность такого воздуха становится равна 2%, а это очень сухой воздух (на самом деле в квартире зимой влажность держится на уровне 10-30% благодаря выделениям влаги из сан-узлов, из кухни и от людей, но что тоже ниже параметров комфорта).
Третий этап:
Что произойдет, если мы опустим температуру до такого уровня, когда “грузоподъемность” воздуха будет ниже, чем количество пара в воздухе? Например, до +5 градусов, где вместимость воздуха равна 5,5 грамм/килограмм. Та часть газообразного h3O, которая не умещается в “кузов” (у нас это 2,5 грамм), начнет превращаться в жидкость, т.е. в воду. В быту особенно хорошо виден этот процесс, когда запотевают окна в связи с тем, что температура стекол ниже, чем средняя температура в комнате, на столько что влаге становится мало места в воздухе и пар, превращаясь в жидкость, оседает на стеклах.
На и-д диаграмме относительная влажность изображается изогнутыми линиями, а информация о градации расположена на самих линиях:
(для увеличения рисунка необходимо щелкнуть и потом еще раз щелкнуть по нему)
Четвертый элемент ID диаграммы – энтальпия (I или i). В энтальпии заложена энергетическая составляющая тепловлажностного состояния воздуха. При дальнейшем изучении (за пределами этой статьи, например в моей статье про энтальпию http://mrcynognathus.livejournal.com/7758.html) стоит обратить на неё особое внимание, когда речь будет заходить об осушении и увлажнении воздуха. Но пока особого внимания на этом элементе мы заострять не будем. Измеряется энтальпия в [кДж/кг]. На и-д диаграмме энтальпия изображается наклонными линиями, а информация о градации расположена на самом графике (или слева и в верхней части диаграммы):
(для увеличения рисунка необходимо щелкнуть и потом еще раз щелкнуть по нему)
Дальше все просто! Пользоваться диаграммой легко! Возьмем, например, вашу комфортную комнату, в которой температура +20°С, и относительная влажность 50%. Находим пересечение этих двух линий (температуры и влажности) и смотрим сколько грамм пара в нашем воздухе.
Нагреваем воздух до +30°С — линия идет вверх, т.к. влаги в воздухе остается столько же, а увеличивается только температура, ставим точку, смотрим какая получается относительная влажность – получилось 27,5%.
Подпишись на мой YouTube-канал FAN-tastiK — канал о проектировании Вентиляции, Кондиционирования и Отопления
Охлаждаем воздух до 5 градусов – опять же ведем вертикальную линию вниз, и в районе +9,5°С натыкаемся на линию 100% относительной влажности. Эта точка называется “точка росы” и в этой точке(теоретически, т.к. практически выпадение начинается чуть раньше) начинается выпадение конденсата. Ниже по вертикальной прямой(как раньше) мы не можем двигаться, т.к. в этой точке “грузоподъемность” воздуха при температуре +9,5°С максимальная. Но нам необходимо охладить воздух до +5°С поэтому мы продолжаем движение вдоль линии относительной влажности (изображено на рисунке ниже), пока не достигнем наклонной прямой линии +5°С. В итоге наша окончательная точка оказалась на пересечении линий температуры +5°С и линии относительной влажности 100%. Посмотрим сколько пара осталось в нашем воздухе – 5,4 грамма в одном килограмме воздуха. А остальные 2,6 грамма выделились. Наш воздух осушился.
(для увеличения рисунка необходимо щелкнуть и потом еще раз щелкнуть по нему)
Другие процессы, которые можно выполнять с воздухом с помощью различных приборов (осушение, охлаждение, увлажнение, нагрев…) можно найти в учебниках.
Помимо точки росы – еще одной важной точкой является “температура мокрого термометра”. Данная температура активно используется в расчете градирен. Грубо говоря, это та точка, до которой может упасть температура предмета, если мы этот предмет обернем в мокрую тряпку и интенсивно начнем на него “дуть”, например, с помощью вентилятора. По этому принципу работает система терморегуляции человека.
Как найти эту точку? Для этих целей нам понадобятся линии энтальпии. Снова возьмем нашу комфортную комнату, найдем точку пересечения линии температуры +20°С, и относительной влажности 50%. Из этой точки необходимо прочертить линию, параллельную линиям энтальпии до линии влажности 100%(как на рисунке ниже). Точка пересечения линии энтальпии и линии относительной влажности и будет являться точкой мокрого термометра. В нашем случае из этой точки мы можем узнать, что в нашей комнате, таким образом, мы можем охладить предмет до температуры +14°С.
(для увеличения рисунка необходимо щелкнуть и потом еще раз щелкнуть по нему)
Луч процесса(угловой коэффициент, тепловлажностное отношение, ε) строится для того чтобы определить изменение воздуха от одновременного выделения неким источником(-ами) тепла и влаги. Обычно этим источником является человек. Очевидная вещь, но понимание процессов и-д диаграммы поможет обнаружить возможную арифметическую ошибку, если таковая случилась. Например, если вы наносите луч на диаграмму и при обычных условиях и наличии людей у вас уменьшается влагосодержание или температура, то здесь стоит задуматься и проверить расчеты.
В данной статье многое упрощено для лучшего понимания диаграммы на начальной стадии её изучения. Более точную, более подробную и более научную информацию необходимо искать в учебной литературе.
P.S. В некоторых источниках I-d(i-d) диаграмму именуют J-d(j-d) диаграммой, h-d диаграммой, диаграммой Молье и диаграммой Рамзина.P.P.S Так же, в моем журнале есть еще одна моя статья, посвященная энтальпии, скрытой холодопроизводительности и определению количества конденсата, образующегося в системах кондиционирования и осушения:
http://mrcynognathus.livejournal.com/7758.html