Температура насыщения водяного пара
Температура насыщения водяного параПромышленные парогенераторы и котельное оборудование
- О компании
- Отзывы
- Проектировщикам
- Новости
- Вакансии
- Вопрос-Ответ
ПОДЕЛИТЬСЯ
| Абсолютное давление, бар |
Температура пара, °С |
Удельный объём пара, м3/кг |
Плотность, кг/м3 | Энтальпия кипя- щей жидкости, ккал/кг |
Скрытая теплота парообразова- ния, ккал/кг |
Энтальпия насы- щенного пара, ккал/кг |
| t | V | Y | i | r | i« | |
| 0,010 | 7,0 | 129,20 | 0,007739 | 7,0 | 593,5 | 600,5 |
| 0,020 | 17,5 | 67,01 | 0,01492 | 17,5 | 587,6 | 605,1 |
| 0,030 | 24,1 | 45,67 | 0,02190 | 24,1 | 583,9 | 608,0 |
| 0,040 | 29,0 | 34,80 | 0,02873 | 28,9 | 581,2 | 610,1 |
| 0,050 | 32,9 | 28,19 | 0,03547 | 32,9 | 578,9 | 611,8 |
| 0,060 | 36,2 | 23,47 | 0,04212 | 36,2 | 577,0 | 613,2 |
| 0,070 | 39,0 | 20,53 | 39,0 | 575,5 | 614,5 | |
| 0,080 | 41,5 | 18,10 | 0,05523 | 41,5 | 574,0 | 615,5 |
| 0,090 | 43,8 | 16,20 | 0,06171 | 43,7 | 572,8 | 616,5 |
| 0,10 | 45,8 | 14,67 | 0,06814 | 45,8 | 571,8 | 617,6 |
| 0,20 | 60,1 | 7,650 | 0,1307 | 60,1 | 563,3 | 623,4 |
| 0,301 | 69,1 | 5,229 | 0,1912 | 69,1 | 558,0 | 627, |
| 0,40 | 75,9 | 3,993 | 0,2504 | 75,8 | 554,0 | 629,8 |
| 0,50 | 81,3 | 3,240 | 0,3086 | 81,3 | 550,7 | 632,0 |
| 0,60 | 86,0 | 2,732 | 0,3661 | 85,9 | 547,9 | 633,8 |
| 0,70 | 90,0 | 2,365 | 0,4229 | 89,9 | 545,5 | 635,4 |
| 0,80 | 93,5 | 2,087 | 0,4792 | 93,5 | 543,2 | 636,7 |
| 0,90 | 96,7 | 1,869 | 0,5350 | 96,7 | 541,2 | 637,9 |
| 1,00 | 99,6 | 1,694 | 0,5904 | 99,7 | 539,3 | 639,0 |
| 1,5 | 111,4 | 1,159 | 0,8628 | 111,5 | 531,8 | 643,3 |
| 2,0 | 120,2 | 0,8854 | 1,129 | 120,5 | 525,9 | 646,4 |
| 2,5 | 127,4 | 0,7184 | 1,392 | 127,8 | 521,0 | 648,8 |
| 3,0 | 133,5 | 1,651 | 134,1 | 516,7 | 650,8 | |
| 3,5 | 138,9 | 0,5240 | 1,908 | 139,5 | 512,9 | 652,4 |
| 4,0 | 143,6 | 0,4622 | 2,163 | 144,4 | 509,5 | 653,9 |
| 4,5 | 147,9 | 0,4138 | 2,417 | 148,8 | 506,3 | 655,1 |
| 5,0 | 151,8 | 0,3747 | 2,669 | 152,8 | 503,4 | 656,2 |
| 6,0 | 158,8 | 0,3155 | 3,170 | 160,1 | 498,0 | 658,1 |
| 7,0 | 164,9 | 0,2727 | 3,667 | 166,4 | 493,3 | 659,7 |
| 8,0 | 170,4 | 0,2403 | 4,162 | 172,2 | 488,8 | 661,0 |
| 9,0 | 175,4 | 0,2148 | 4,655 | 177,3 | 484,8 | 662,1 |
| 10 | 179,9 | 0,1943 | 5,147 | 182,1 | 481,0 | 663,1 |
| 11 | 184,1 | 0,1774 | 5,637 | 186,5 | 477,4 | 663,9 |
| 12 | 188,0 | 0,1632 | 6,127 | 190,7 | 473,9 | 664,6 |
| 13 | 191,6 | 0,1511 | 6,617 | 194,5 | 470,8 | 665,3 |
| 14 | 195,0 | 0,1407 | 7,106 | 198,2 | 467,7 | 665,9 |
| 15 | 198,3 | 0,1317 | 7,596 | 201,7 | 464,7 | 666,4 |
| 16 | 201,4 | 0,1237 | 8,085 | 205,1 | 461,7 | 666,8 |
| 17 | 0,1166 | 8,575 | 208,2 | 459,0 | 667,2 | |
| 18 | 207,1 | 0,1103 | 9,065 | 211,2 | 456,3 | 667,5 |
| 19 | 209,8 | 0,1047 | 9,555 | 214,2 | 453,6 | 667,8 |
| 20 | 212,4 | 0,09954 | 10,05 | 217,0 | 451,1 | 668,1 |
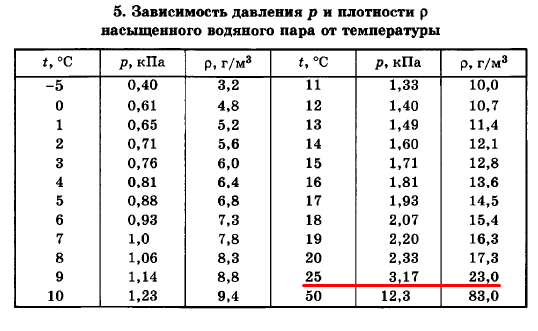
| 25 | 223,9 | 0,07991 | 12,51 | 229,7 | 439,3 | 669,0 |
| 30 | 233,8 | 0,06663 | 15,01 | 240,8 | 428,5 | 669,3 |
| 40 | 250,3 | 0,04975 | 20,10 | 259,7 | 409,1 | 668,8 |
| 50 | 263,9 | 0,03943 | 25,36 | 275,7 | 391,7 | 667,4 |
| 60 | 275,6 | 0,03244 | 30,83 | 289,8 | 375,4 | 665,2 |
| 70 | 285,8 | 0,02737 | 36,53 | 302,7 | 359,7 | 662,4 |
| 80 | 295,0 | 0,02353 | 42,51 | 314,6 | 344,6 | 659,2 |
| 90 | 303,3 | 0,02050 | 48,79 | 325,7 | 329,8 | 655,5 |
| 100 | 311,0 | 0,01804 | 55,43 | 336,3 | 315,2 | 651,5 |
| 110 | 318,1 | 0,01601 | 62,48 | 346,5 | 300,6 | 647,1 |
| 120 | 324,7 | 0,01428 | 70,01 | 356,3 | 286,0 | 642,3 |
| 130 | 330,8 | 0,01280 | 78,14 | 365,9 | 271,1 | 637,0 |
| 140 | 336,6 | 0,01150 | 86,99 | 375,4 | 255,7 | 631,1 |
| 150 | 342,1 | 0,01034 | 96,71 | 384,7 | 239,9 | 624,6 |
| 200 | 365,7 | 0,005877 | 170,2 | 436,2 | 141,4 | 577,6 |
Понравилась статья? Подписывайся!
Подписаться Подписаться Подписаться Подписаться ПодписатьсяИнтересные вопросы еще
Первый пуск электрического парогенератора ПАР
тех. вопросы
Как и чем промывать теплообменники
теплообменники
Что такое избыточное давление
тех.вопросы
Принцип работы деаэратора
тех.вопросы
вопросы
Как и чем промывать теплообменники
теплообменники
Что такое избыточное давление
тех.вопросы
Принцип работы деаэратора
тех.вопросы
К списку вопросов
Насыщенный и ненасыщенный пар — определение, свойства, формулы
Покажем, как применять знание физики в жизни
Начать учиться
Оказывается, у насыщенного пара и бизнес-центра много общего, а чтобы вскипятить чайник при температуре меньше 100°C, нужно забраться на Эльбрус.
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
На схеме — названия всех фазовых переходов:
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.
Пятерка по физике у тебя в кармане!
Решай домашку по физике на изи. Подробные решения помогут разобраться в сложной теме и получить пятерку!
Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости. Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. 🤔 Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
|
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
Испарение | Кипение |
|---|---|
|
|
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
t, °C | Вещество |
|---|---|
-253 -183 35 78 100 357 3050 4200 5657 | водород кислород эфир спирт вода ртуть железо графит вольфрам |
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
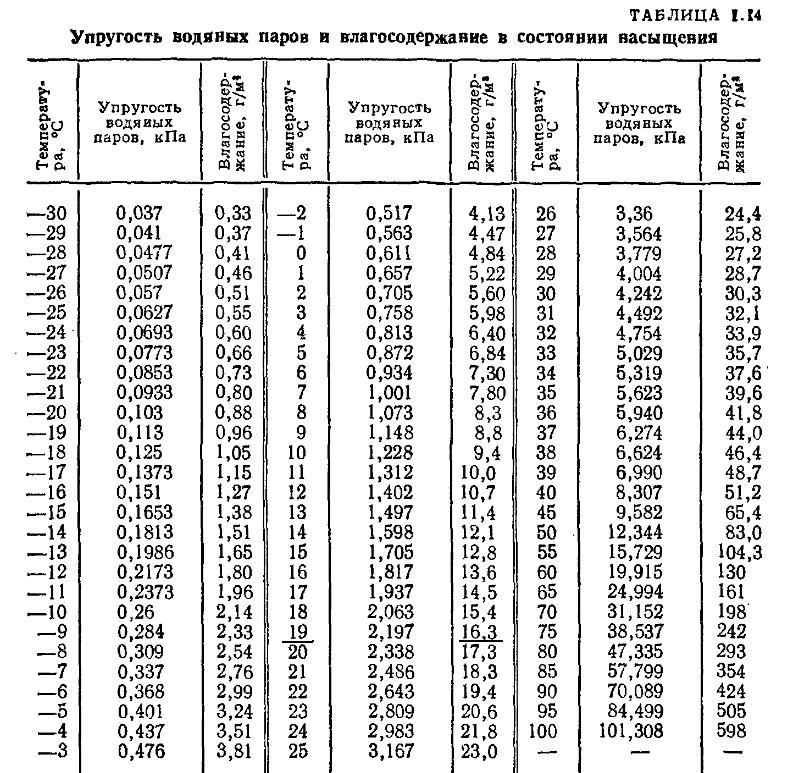
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный. |
Свойства насыщенного пара
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
Давление насыщенного пара не зависит от его объема.

Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
Уравнение Менделеева-Клапейрона
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
R = 8,31 м2 × кг × с-2 × К-1 × моль-1
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.

В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
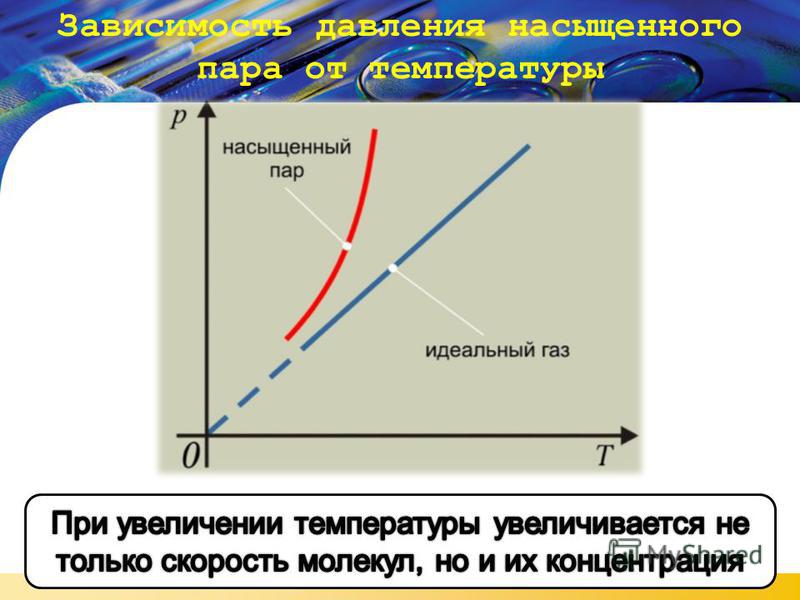
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Решение задач по теме «Насыщенный пар»
Применим свойства насыщенного пара при решении задач.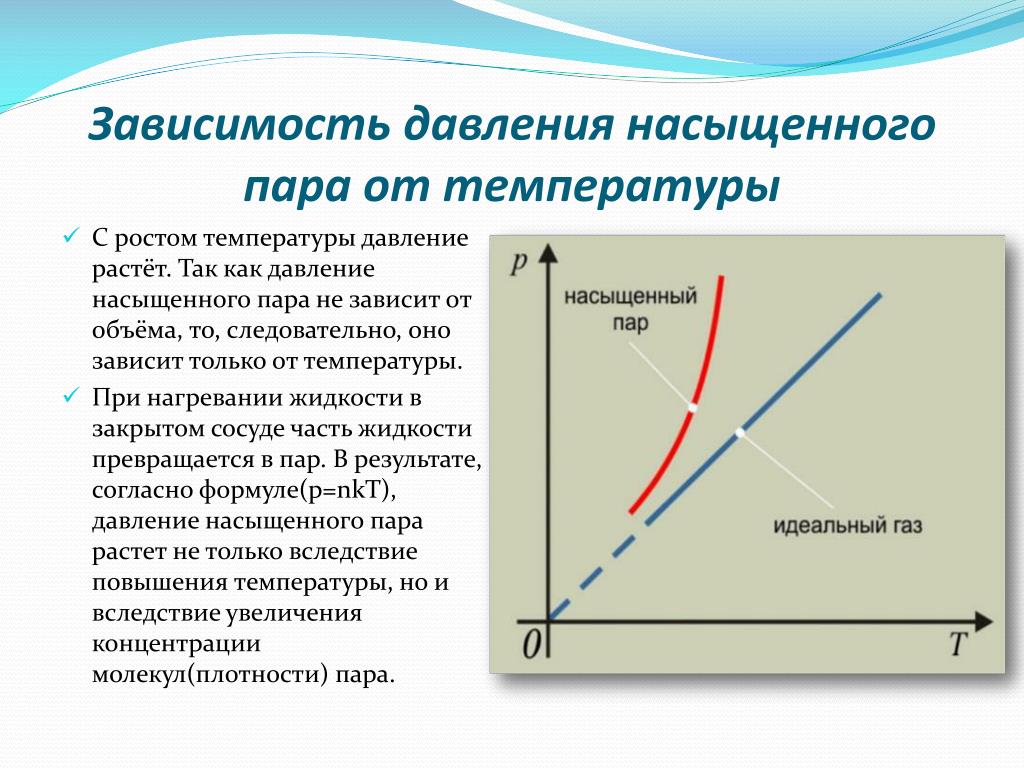
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
pV = νRT
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.

Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.
Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины: T = 100 + 273 = 373 K
Карина Хачатурян
К предыдущей статье
Закон Паскаля
К следующей статье
114.5K
Архимедова сила
Получите индивидуальный план обучения физике на бесплатном вводном уроке
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Вода — Давление насыщения в зависимости от температуры
Вода имеет тенденцию испаряться или испаряться, выбрасывая молекулы в пространство над своей поверхностью. Если пространство ограничено, парциальное давление, оказываемое молекулами, увеличивается до тех пор, пока скорость, с которой молекулы снова входят в жидкость, не сравняется со скоростью, с которой они выходят. Давление пара воды – это давление, при котором водяной пар находится в термодинамическом равновесии со своим конденсированным состоянием . При более высоком давлении вода будет конденсироваться. В этом равновесном состоянии давление пара равно давление насыщения .
Если пространство ограничено, парциальное давление, оказываемое молекулами, увеличивается до тех пор, пока скорость, с которой молекулы снова входят в жидкость, не сравняется со скоростью, с которой они выходят. Давление пара воды – это давление, при котором водяной пар находится в термодинамическом равновесии со своим конденсированным состоянием . При более высоком давлении вода будет конденсироваться. В этом равновесном состоянии давление пара равно давление насыщения .
Онлайн-калькулятор давления насыщения водой
Приведенный ниже калькулятор можно использовать для расчета давления насыщения водой при заданных температурах.
Давление на выходе указывается в кПа, бар, атм, фунт/кв.дюйм (фунт/дюйм 2 ) и фунт/фут (фунт/фут 2 ).
Температура должна быть в пределах 0–370 °C, 32–700 °F, 273–645 K и 492–1160 °R
Температура
Выберите фактическую единицу измерения температуры:°C °F K °R
Давление насыщения воды зависит от температуры, как показано ниже:
Термодинамические свойства при стандартных условиях см. в разделе «Вода и тяжелая вода».
в разделе «Вода и тяжелая вода».
См. также другие свойства Вода при различной температуре и давлении : Температуры кипения при высоком давлении, Температуры кипения при вакууме, Плотность и удельный вес, Динамическая и кинематическая вязкость, Энтальпия и энтропия, Теплота парообразования, Постоянная ионизации , пК w , нормальной и тяжелой воды, температуры плавления при высоком давлении, число Прандтля, свойства в условиях газожидкостного равновесия, удельный вес, удельная теплоемкость (теплоемкость), удельный объем, теплопроводность, температуропроводность и давление пара в газе -жидкостное равновесие.
Давление насыщения при температуре, указанной в градусах Цельсия, и
давление, указанное в килоПаскалях [кПа], барах, атмосферах [атм] и фунтах на квадратный дюйм [psi]:
| Temperature | Water saturation pressure | ||||||
| [°C] | [kPa], [100*bar] | [atm] | [psi] | ||||
0. 01 01 | 0.61165 | 0.0060 | 0.088712 | ||||
| 2 | 0.70599 | 0.0070 | 0.10240 | ||||
| 4 | 0.81355 | 0.0080 | 0.11800 | ||||
| 10 | 1.2282 | 0.0121 | 0.17814 | ||||
| 14 | 1.5990 | 0.0158 | 0.23192 | ||||
| 18 | 2.0647 | 0.0204 | 0,29946 | ||||
| 20 | 2,3393 | 0,0231 | 0,33929 | ||||
| 25 | 3,16979 | 0.0313 | 0.45976 | ||||
| 30 | 4.2470 | 0.0419 | 0.61598 | ||||
| 34 | 5.3251 | 0.0526 | 0.77234 | ||||
| 40 | 7.3849 | 0.0729 | 1.0711 | ||||
| 44 | 9.1124 | 0,0899 | 1,3216 | ||||
| 50 | 12,352 | 0,122 | 12,352 | 0,122 | 12,352 | 0,122 | 0054 1. 7915 7915 |
| 54 | 15.022 | 0.148 | 2.1788 | ||||
| 60 | 19.946 | 0.197 | 2.8929 | ||||
| 70 | 31.201 | 0.308 | 4.5253 | ||||
| 80 | 47.414 | 0.468 | 6.8768 | ||||
| 90 | 70.182 | 0.693 | 10.179 | ||||
| 96 | 87.771 | 0.866 | 12.730 | ||||
| 100 | 101.42 | 1.001 | 14.710 | ||||
| 110 | 143.38 | 1.42 | 20.796 | ||||
| 120 | 198,67 | 1,96 | 28,815 | ||||
| 130 | 270,28 | 2,67 | 39,201 | 2,67 | 39,201 | 0062||
| 140 | 361. 54 54 | 3.57 | 52.437 | ||||
| 150 | 476.16 | 4.70 | 69.061 | ||||
| 160 | 618.23 | 6.10 | 89.667 | ||||
| 180 | 1002.8 | 9,90 | 145,44 | ||||
| 200 | 1554,9 | 15,35 | 225,52 | ||||
| 220 | 443191919 2 | ||||||
| 220 | 4431191919191919 2 | ||||||
| 220 | 225,52 2.622.89 | 336.43 | |||||
| 240 | 3346.9 | 33.03 | 485.43 | ||||
| 260 | 4692.3 | 46.31 | 680.56 | ||||
| 280 | 6416.6 | 63.33 | 930.65 | ||||
| 300 | 8587,9 | 84,76 | 1245,6 | ||||
| 320 | 11284 | 111,4 | 11284 | 111,4 | 0054 1636.|||
| 340 | 14601 | 144.1 | 2117.7 | ||||
| 360 | 18666 | 184.2 | 2707.3 | ||||
| 370 | 21044 | 207.7 | 3052.2 | ||||
Давление насыщения при температуре, указанной в градусах Фаренгейта, и давлении
, указанном в фунтах на квадратный дюйм [psi], фунтах на квадратный фут [psf], килоПаскалях [кПа] и барах:
| Temperature | Water saturation pressure | ||||||||
| [°F] | [psi] | [psf] | [kPa], [100 *bar] | ||||||
| 32.02 | 0.088712 | 12.775 | 0.612 | ||||||
| 34 | 0.09624 | 13.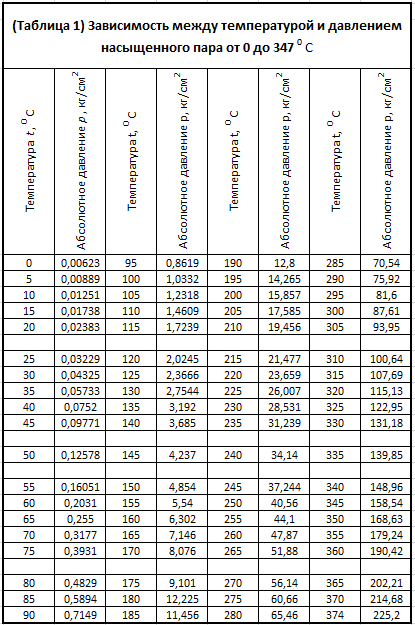 858 858 | 0.664 | ||||||
| 39.2 | 0.11800 | 16.991 | 0.814 | ||||||
| 40 | 0.12170 | 17.524 | 0.839 | ||||||
| 50 | 0.17814 | 25.651 | 1.228 | ||||||
| 60 | 0.25633 | 36.912 | 1,767 | ||||||
| 70 | 0,36341 | 52,330 | 2,506 | ||||||
| 80 | 0.5075999 | ||||||||
| 80 | 0,507599 | 73.092 | 3.500 | ||||||
| 90 | 0.69915 | 100.7 | 4.821 | ||||||
| 100 | 0.95055 | 136.9 | 6.554 | ||||||
| 110 | 1.2766 | 183.8 | 8.802 | ||||||
| 120 | 1.6949 | 244.1 | 11,686 | ||||||
| 130 | 2,2258 | 320,5 | 15,347 | 320,5 | 15,347 | 320,5 | 15,347 | 320,5 | 15,347 | 0057
| 140 | 2. 8929 8929 | 416.6 | 19.946 | ||||||
| 150 | 3.7232 | 536.1 | 25.671 | ||||||
| 160 | 4.7474 | 683.6 | 32.732 | ||||||
| 170 | 5.9999 | 864,0 | 41.368 | ||||||
| 180 | 7,5196 | 1083 | 51,846 | ||||||
| 190 90 90 9.0057 | 9.3495 | 1346 | 64.462 | ||||||
| 200 | 11.537 | 1661 | 79.547 | ||||||
| 212 | 14.710 | 2118 | 101.42 | ||||||
| 220 | 17.203 | 2477 | 118,6 | ||||||
| 240 | 25,001 | 3600 | 172,4 | 3600 | 172,4 | 0053 | 260 | 35.263 | 5078 | 243. 1 1 |
| 280 | 49.286 | 7097 | 339.8 | ||||||
| 300 | 67.264 | 9686 | 463.8 | ||||||
| 350 | 134.73 | 19402 | 929.0 | ||||||
| 400 | 247.01 | 35570 | 1703.1 | ||||||
| 450 | 422.3299 | ||||||||
| 450 | 422.32 9006 | 60814 | 2911.8 | ||||||
| 500 | 680.56 | 98001 | 4692.3 | ||||||
| 550 | 1045.0 | 150485 | 7205.3 | ||||||
| 600 | 1542.1 | 222066 | 10632.6 | ||||||
| 625 | 1851,2 | 266570 | 12763 | ||||||
| 650 | 7 70927,8 9 00547 | 15222 | |||||||
| 675 | 2618.7 | 377092 | 18055 | ||||||
| 700 | 3092.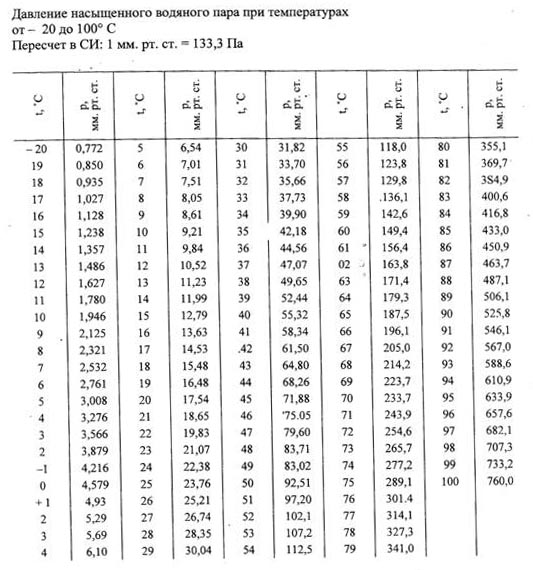 0 0 | 445243 | 21318 | ||||||
See also Air Psychrometrics and Steam & Condensate Systems
Saturation Vapor Pressure of некоторые другие жидкости при 68
o F или 20 o C| Жидкость | Давление насыщенного пара | |
|---|---|---|
| [psi] | [Pa] | |
| Carbon tetrachloride,CCl 4 | 1.9 | 13100 |
| Gasoline | 8.0 | 55200 |
| Mercury | 0.000025 | 0.17 |
- 1 PA = 10 -6 N/MM 2 = 10 -5 BAR = 0,1020 KP/M 2 = 1,02×10 -4 M 2 = 1,02×10 -4 M 2 = 1,02×10 -4 M 2 = 1,02×10 -4 M 2 = 1,02×10 -4 M 2 = 1,02×10 -4 .
 х10 -6 атм = 1,45×10 -4 psi ( фунтов f / дюйм 2 )
х10 -6 атм = 1,45×10 -4 psi ( фунтов f / дюйм 2 )
График температуры насыщения и PT для специалистов по ОВиК.
Что такое температура насыщения и почему она важна?
Одним из многих понятий, которые необходимо понимать специалистам в области ОВиК, является температура насыщения; это включает в себя знание того, как его рассчитать и как использовать график PT (давление-температура).
В частности, специалисты по HVAC обычно применяют эти знания к пару или воде и хладагенту. Вы будете использовать температуру насыщения в различных расчетах и устранении неполадок, в том числе при расчете перегрева. Для тех, кто нуждается в освежении, перегрев предоставляет ценную информацию об эффективности системы и о том, может ли жидкость просачиваться в области системы, которых не должно быть.
Что такое температура насыщения?
Температура насыщения — это просто официальное название точки кипения. Термин «насыщение» происходит от того факта, что это температура, при которой жидкость должна закипеть и перейти в паровую фазу, в зависимости от ее давления насыщения.
Термин «насыщение» происходит от того факта, что это температура, при которой жидкость должна закипеть и перейти в паровую фазу, в зависимости от ее давления насыщения.
При постоянном давлении, если отвести тепло и получить пар при температуре насыщения, он сконденсируется и станет жидкостью. Обратное тоже верно. Если у вас есть жидкость при температуре насыщения и постоянном давлении и добавлении тепла, она закипит и войдет в тепловую фазу. Вы можете понять это, подумав о своем опыте кипячения кастрюли с водой.
Как рассчитать температуру насыщения?
Вы можете рассчитать температуру насыщения, выполнив следующие шаги, или использовать более простой вариант, описанный ниже.
– Шаг 1 : Измерьте температуру системы в градусах Цельсия. Преобразуйте его в Кельвины, добавив 273 градуса.
– Шаг 2 : Используйте уравнение Клаузиуса-Клапейрона для расчета давления насыщения. Уравнение выглядит следующим образом:
– Шаг 2a : Мы также запишем эти шаги. В уравнении вы должны найти натуральный логарифм вашего давления насыщения, но разделить его на 6,11. 96 Дж/кг, а газовая постоянная влажного воздуха 461 Дж/кг. Выполнение необходимого деления на первом этапе равно 5 321,0412.
В уравнении вы должны найти натуральный логарифм вашего давления насыщения, но разделить его на 6,11. 96 Дж/кг, а газовая постоянная влажного воздуха 461 Дж/кг. Выполнение необходимого деления на первом этапе равно 5 321,0412.
– Шаг 2c : Теперь вы можете решить уравнение, включая натуральный логарифм, представив каждую часть уравнения как степень e. Помните, что ваш результат равен давлению насыщения, деленному на 6,11, поэтому вам придется умножить обе части уравнения на 6,11, чтобы получить давление насыщения.
– Шаг 3 : Используйте карту PT, чтобы найти рассчитанное вами давление насыщения. Карта покажет вам температуру.
Вы также можете выполнить эти шаги и использовать свою диаграмму, метод, который намного проще и зависит от таких инструментов, как манометры, которые у вас, вероятно, есть под рукой.
– Шаг 1 : Используйте инструмент для измерения давления в рассматриваемом месте, например манометр.
– Шаг 2 : Используйте диаграмму PT, чтобы найти температуру насыщения.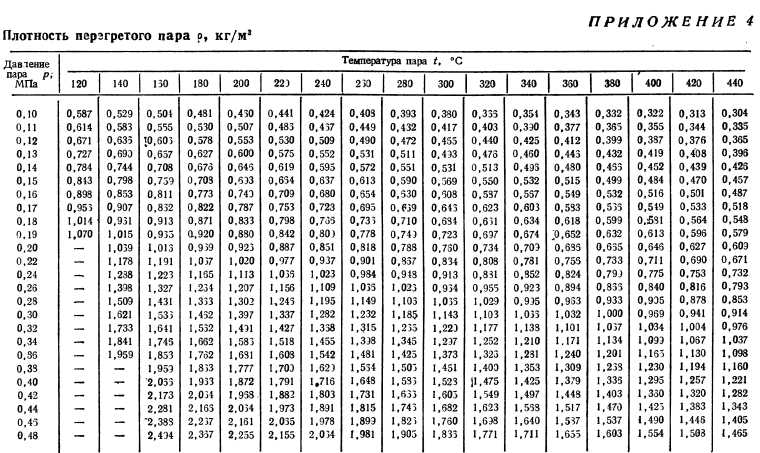
Чтобы сделать расчет температуры насыщения еще проще, некоторые ученые работают над созданием новых формул, более простых, но точных.
Конечно, вы также можете получить точные значения температуры насыщения, используя предыдущие шаги, и этот метод легче использовать большинству специалистов по ОВКВ.
Онлайн-калькуляторы
Специалисты по ОВиК — далеко не единственные люди, которым время от времени или регулярно требуется рассчитывать температуру насыщения, поэтому существует множество онлайн-калькуляторов, которые помогут вам. Большинство из них сосредоточены на обычных веществах, таких как вода.
Вы можете предложить своим техническим специалистам использовать эти онлайн-калькуляторы в качестве обучающего инструмента для проверки своих математических расчетов при обучении расчету температуры насыщения. В этом случае они рассчитывали температуру насыщения воды в данном реальном или теоретическом случае, а затем использовали онлайн-калькулятор для подтверждения своей работы. Это может дать им дополнительную практику, прежде чем применять те же знания для расчета температуры насыщения хладагента или других веществ, с которыми они взаимодействуют.
Это может дать им дополнительную практику, прежде чем применять те же знания для расчета температуры насыщения хладагента или других веществ, с которыми они взаимодействуют.
Основные тенденции, влияющие на температуру насыщения – увеличивается ли насыщенность с температурой?
Да, при повышении температуры воздуха большее количество воды может оставаться в газообразном состоянии, увеличивая насыщение. Когда температура падает, молекулы воды замедляются, увеличивая вероятность их конденсации в жидкость.
На следующей диаграмме показано, как это работает для воды, в частности, как повышение температуры увеличивает давление пара.
Помните о взаимосвязи между давлением и насыщением – более высокое давление пара соответствует более высокому насыщению.
Отдельные части температуры насыщения.
Лучше поняв температуру насыщения, пора взглянуть на некоторые связанные расчеты и температуру насыщения конкретных веществ.
Что такое температура насыщения хладагента?
Температура насыщения хладагентом зависит от давления.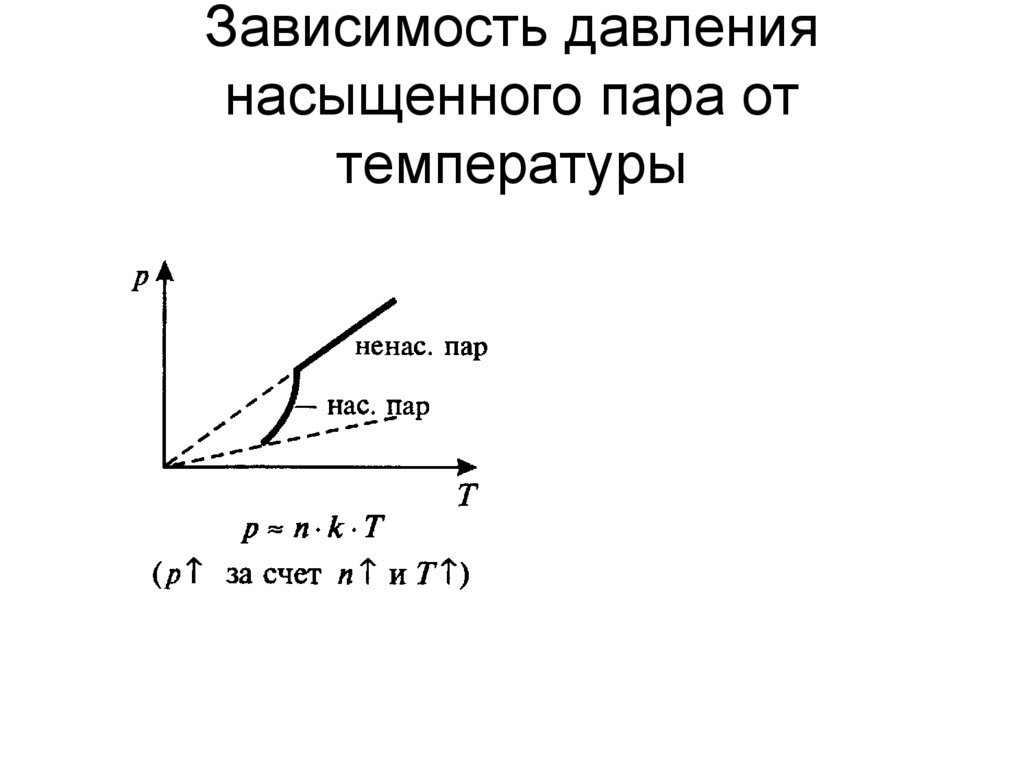 Основываясь на сравнении, считайте, что вода имеет температуру насыщения или точку кипения 212 по Фаренгейту или 100 по Цельсию на уровне моря. При увеличении давления будет увеличиваться и температура насыщения. Если давление уменьшится, то и температура насыщения уменьшится.
Основываясь на сравнении, считайте, что вода имеет температуру насыщения или точку кипения 212 по Фаренгейту или 100 по Цельсию на уровне моря. При увеличении давления будет увеличиваться и температура насыщения. Если давление уменьшится, то и температура насыщения уменьшится.
Существует аналогичная картина для температуры насыщения хладагента, но она также зависит от самого хладагента. Одним из примеров является то, что температура кипения R-22 составляет 45 градусов по Фаренгейту при давлении 76 фунтов на квадратный дюйм. Любое изменение давления изменит температуру насыщения.
Какова температура насыщения пара?
На следующих диаграммах показана температура насыщения пара, а также некоторые другие термодинамические свойства.
Наука о насыщенном паре.
Насыщенный пар относится к чистому пару, который вступает в контакт с водой, из которой он получен, которая все еще находится в жидкой форме. Важно, что насыщенный пар будет иметь температуру, которая должна соответствовать воде (жидкости, а не газу) при ее давлении.
Насыщенный пар, также известный как сухой пар, возникает, когда вода или вещество имеют температуру, при которой возможно образование газа или жидкости. Появление насыщенного пара означает, что скорости конденсации и испарения одинаковы.
Техники HVAC и насыщенный пар.
Специалисты по системам отопления, вентиляции и кондиционирования воздуха обычно работают с насыщенным паром из-за преимуществ, которые он дает для обогрева.
- Скрытая теплопередача обеспечивает быстрый нагрев.
- Использование воды является недорогим, чистым и безопасным нагревательным средством.
- Вы можете использовать давление для точной и контролируемой регулировки температуры.
- Насыщенная вода имеет высокий коэффициент теплопередачи, а это означает, что ей не нужна большая площадь поверхности для передачи тепла, что снижает количество необходимого оборудования.
Графики температуры насыщения в сравнении с альтернативными вариантами – как использовать графики PT для достижения успеха.

Имея дело с температурой насыщения в качестве специалиста по ОВиК, вы часто будете использовать диаграмму PT (давление и температура). В прошлом это всегда должны были быть физические диаграммы, которые технические специалисты брали с собой, но теперь существует множество приложений для смартфонов, которые включают диаграммы, экономя место.
Ниже приведен пример диаграммы PT, которую могут использовать специалисты по ОВиК.
Использовать PT-диаграмму довольно просто. Вы смотрите на давление насыщения для данного хладагента, а затем смотрите, какой температуре насыщения оно соответствует. Выше приведен пример традиционной диаграммы, которая показывает температуру и давление в фунтах на квадратный дюйм.
Этот тип диаграммы является общим для однокомпонентных хладагентов, так как они будут иметь единую точку кипения. Однако существуют также зеотропные смеси с несколькими компонентами, и они подвергаются фракционированию, когда одна из их характеристик переходит в пар или жидкость быстрее, чем другая.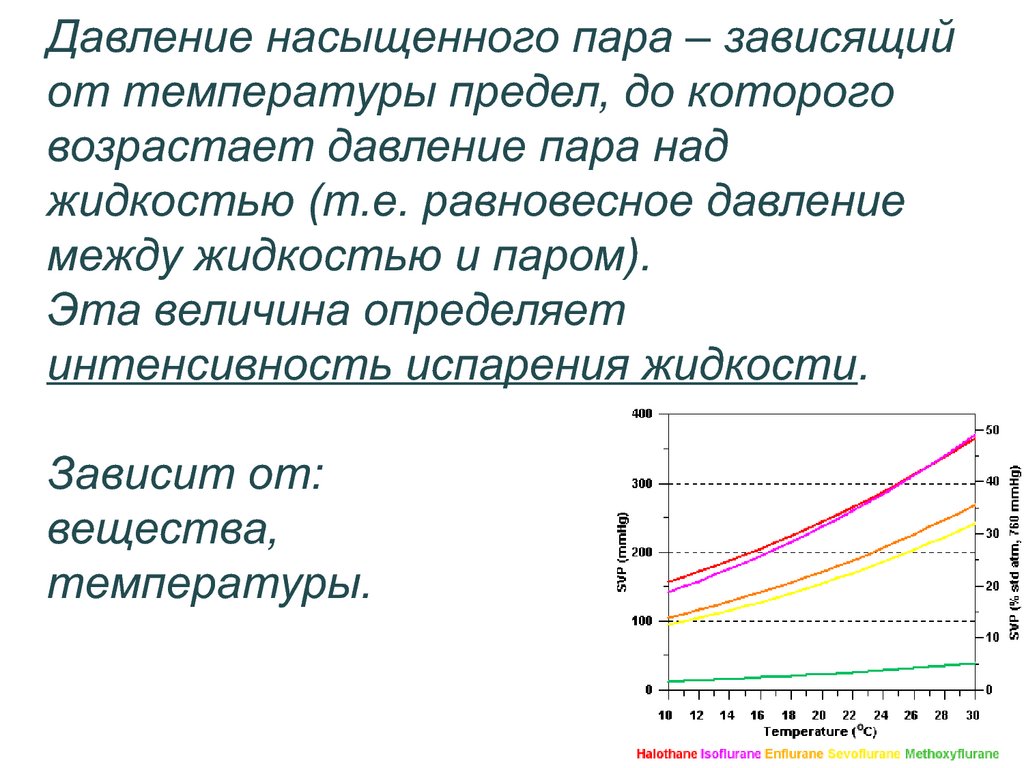
Эти диаграммы PT будут выглядеть следующим образом:
При использовании хладагентов с несколькими компонентами и чтении этих диаграмм следует уделять наибольшее внимание конечным точкам «скольжения». Другими словами, следует обратить внимание на тот компонент, который изменит фазы первым. Диаграммы
PT являются популярным инструментом для нескольких целей в HVAC, в том числе:
- Подтверждение давления в змеевике, необходимого для достижения нужной температуры хладагента
- Расчет перегрева (нагрев выше температуры, при которой хладагент был бы насыщен, или температуры его насыщения, особенно на выходе из испарителя)
- Расчет переохлаждения (охлаждение ниже температуры насыщения, особенно со стороны конденсатора)
Заключение: почему температура насыщения важна для профессионалов в области ОВКВ.
Специалисты в области ОВиК будут регулярно использовать температуру насыщения и диаграммы PT при настройке систем, устранении неполадок и решении этих проблем.

 6
6