Удельная теплота сгорания — формула и обозначения
Покажем, как применять знание физики в жизни
Начать учиться
Погреться у батареи зимой и заварить чаёк не получилось бы, если бы человечество не научилось использовать энергию. А рождается эта энергия благодаря сгоранию топлива.
Виды топлива
Человеку очень нужно тепло для всех процессов жизнедеятельности: например, для обогрева жилища, готовки, плавления металлов и получения других видов энергии. Чтобы получать тепло и свет, человек использует топливо. Когда люди впервые добыли огонь, без топлива тоже не обошлось — им послужила древесина.
Топливо — это любое вещество, выделяющее энергию в ходе сгорания.
Существует четыре группы видов топлива:
- твердое топливо,
- жидкое топливо,
- газообразное топливо.

На самом деле есть еще четвертая группа — ядерное топливо, но в этом случае механизм получения энергии другой. О нем мы рассказали в статье про ядерный реактор.
К твердому топливу относятся:
- древесина,
- горючие сланцы,
- уголь,
- торф.
Ископаемые твердые виды топлива, кроме сланцев, являются продуктом разложения органической массы растений. Торф — самый молодой из них, он представляет собой плотную массу, которая образовалась из перегнивших болотных растений. Уже не такие молодые (скажем, средних лет 🤣) бурые угли — это темная однородная масса, которая окисляется и рассыпается на свежем воздухе. Горючие сланцы — полезные ископаемые, дающие смолу. Каменные угли — ребята с повышенной прочностью и небольшой пористостью.
Жидкое топливо — это, например, бензин или нефть. Газообразное — это смесь, содержащая в себе водород и окись углерода.
Газообразное — это смесь, содержащая в себе водород и окись углерода.
В горючей части топлива всегда есть углерод, кислород, водород, сера и азот. Кислород в соединении с углеродом или водородом уменьшает тепло, которое выделяется в процессе горения. Азот переходит в продукты сгорания, не окисляясь. Сера — вредная примесь, при сгорании которой выделяется в 4 раза меньше теплоты, чем при сгорании углерода.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Удельная теплота сгорания топлива
Удельная теплота сгорания определяет энергетическую ценность топлива. Эта величина фигурирует в формуле количества теплоты, выделяемого при сгорании топлива.
Количество теплоты, выделяемое при сгорании топлива Q = qm Q — количество теплоты [Дж] q — удельная теплота сгорания [Дж/м3] m — масса [кг] |
Удельная теплота сгорания — это табличная величина, которая показывает, какое количество энергии выделится при сгорании 1 кг топлива.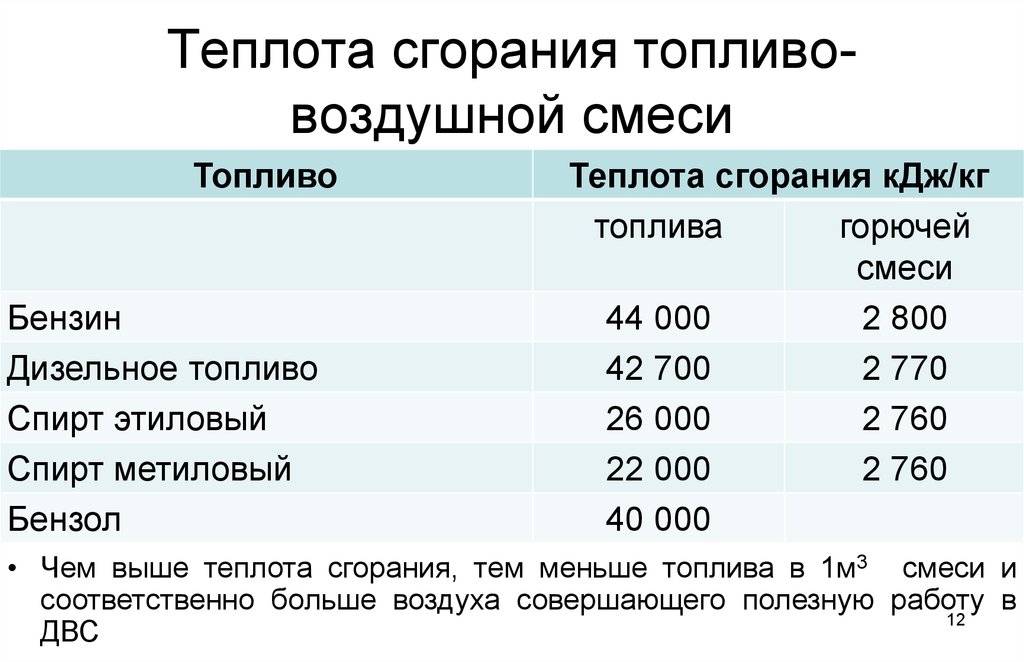
Ниже представлены таблицы с некоторыми значениями удельной теплоты сгорания.
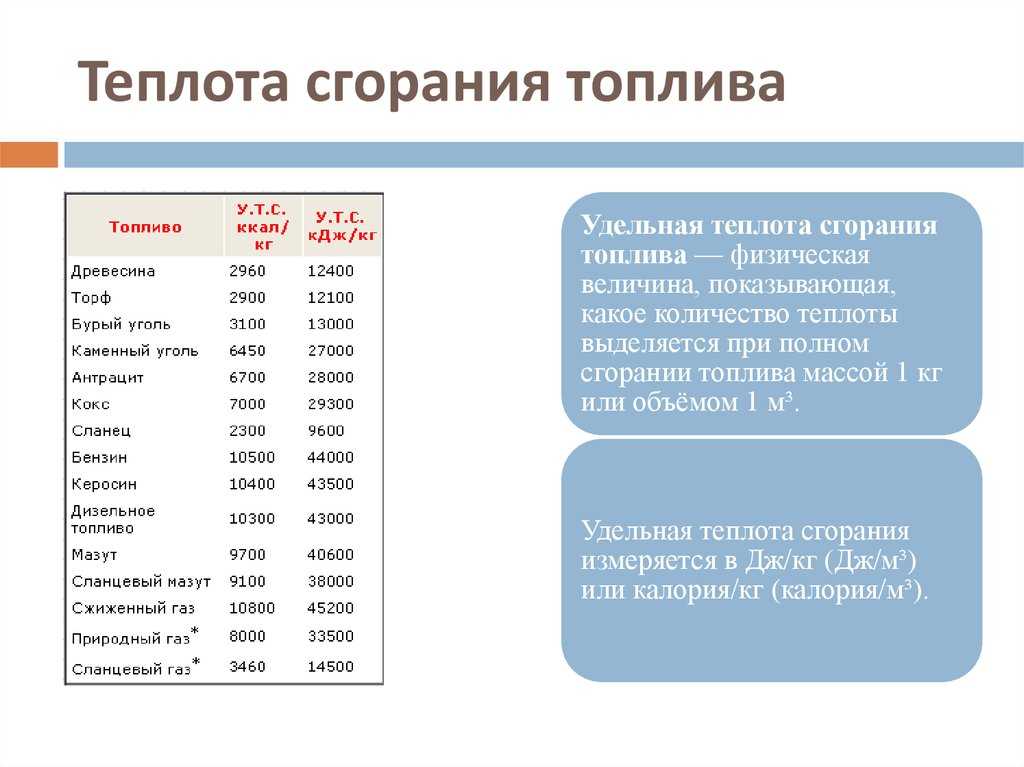
Твердое топливо
Вещество | Удельная теплота сгорания, МДж/кг |
|---|---|
Бурый уголь | 9,3 |
Древесный уголь | 29,7 |
Сухие дрова | 8,3 |
Древесные чурки | 15,0 |
Каменный уголь марки А-I | 20,5 |
Каменный уголь марки А-II | 30,3 |
Кокс | 30,3 |
Порох | 3,0 |
Торф | 15,0 |
Жидкое топливо
Вещество | Удельная теплота сгорания, МДж/кг |
|---|---|
Бензин, нефть | 46,0 |
Дизельное топливо | 42,0 |
Керосин | 43,0 |
Мазут | 40,0 |
Этиловый спирт | 27,0 |
Газообразное топливо
Вещество | Удельная теплота сгорания, МДж/м³ |
|---|---|
Водород | 120,8 |
5,5 | |
Коксовый газ | 16,4 |
Природный газ | 35,5 |
Светильный газ | 21,0 |
Решение задач
Задачка простая
В топке паровой машины сгорело 50 кг каменного угля, удельная теплота сгорания которого равна 30 МДж/кг. Какое количество теплоты выделилось в этом процессе?
Какое количество теплоты выделилось в этом процессе?
Решение
В условии задачи есть все необходимые данные, поэтому переводим их в СИ и подставляем в формулу.
СИ — международная система единиц. «Перевести в СИ» означает перевести все величины в метры, секунды и другие единицы измерения без приставок. Исключение — килограмм с приставкой «кило».
Переводим удельную теплоту сгорания в СИ:
30 МДж/кг = 30 000 000 Дж/кг
Подставляем значения в формулу:
Q = qm = 30 000 000 50 = 1 500 000 000 = 1500 МДж
Ответ: в процессе сгорания выделилось 1500 МДж.
Задачка сложная
Сколько килограммов воды можно нагреть на спиртовке при температуре 30°С, если сжечь в ней 21 грамм спирта? КПД спиртовки равен 30%.
Удельная теплота сгорания спирта — 2,9·107 Дж/кг.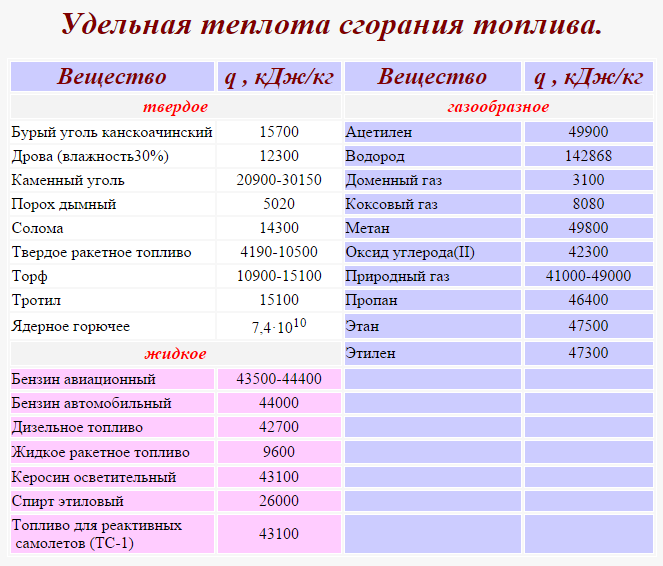
Удельная теплоемкость воды — 4200 Дж/(кг·°С).
Решение
кг
Ответ: можно нагреть 1,45 кг воды.
Попробуйте подготовку к ЕГЭ по физике онлайн с опытным преподавателем в Skysmart!
Карина Хачатурян
К предыдущей статье
143.1K
Ускорение свободного падения
К следующей статье
Фотон
Получите индивидуальный план обучения физике на бесплатном вводном уроке
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Что такое теплота сгорания топлива и от чего она зависит
Оглавление:
1. Что такое теплота сгорания топлива.
Что такое теплота сгорания топлива.
2. Теплота сгорания бензина.
3. Теплота сгорания керосина.
4. Теплота сгорания дизельного топлива.
1. Что такое теплота сгорания топлива
Сегодня мы выясним, что такое «теплота сгорания топлива», определим ее показатели для разных видов горючего и что на них влияет.
По своей сути топливо – энергоноситель, который при определенных условиях выделяет некоторое количество тепловой энергии. Это зависит от содержания в нем окислителя. Химический состав топливной смеси и его состояния (газ, жидкость) определяет выделяемую энергию. Чем в большем количестве поступает энергия сгорания топлива, тем меньше расходуется горючего при неизменном показателе коэффициента полезного действия. При этом теплота сгорания классифицируется на высшую и низшую (в зависимости от количества израсходованной энергии и количества влаги).
Так, теплота сгорания топлива представляет собой основной показатель энергии, определяет количество полностью сгоревшего горючего и полученную при этом энергию.
Для сравнительных расчетов теплотворности различных видов топлива используют минимальное значение теплоты сгорания (29 308 кДж/кг).
|
Топливо |
Удельная теплота сгорания |
||
|
ккал |
кВт |
МДж |
|
|
Мазут |
9700 |
11,2 |
40,61 |
|
Дизельное топливо (солярка) |
10 300 |
11,9 |
43,12 |
|
Метан |
11 950 |
13,8 |
50,03 |
|
Газ сжиженный |
10 800 |
12,5 |
45,20 |
|
Газ природный |
8000 |
9,3 |
33,50 |
|
Бензин |
10 500 |
12,2 |
44,00 |
|
Пропан |
10 885 |
12,6 |
45,57 |
При этом стоит учитывать, что теплота сгорания зависит от множества критериев: влажности, сернистости, зольности.
2. Теплота сгорания бензина
Теплота сгорания бензина практически одинакова для различных марок. Она варьируется в пределах 43,5–44,5 кДж/кг. Данные показатели не зависят от октанового числа бензина и определяются составом топлива. При этом содержащийся в нем водород существенно снижает тепловую ценность бензина из-за возможности связывания с кислородом и образования влаги.
3. Теплота сгорания керосина
Определить точные показатели теплоты сгорания керосина нельзя, так как процентное содержание додекана, тридекана, тетрадекана, пентадекана в каждой партии топлива отличается. Поэтому для различных групп удельная теплота сгорания керосина составляет 43000±1000 кДж/кг. Она обусловлена характеристиками нефти. При этом на теплоту сгорания влияют плотность и вязкость керосина, которые зависят от внешних температур. Отмечено, что при повышении температуры резко возрастает удельная теплоемкость.
4.
 Теплота сгорания дизельного топлива
Теплота сгорания дизельного топливаОсновным показателем влияния на КПД моторов при использовании дизельного топлива служит теплота сгорания. Она определяет процент расхода топлива и показатели КПД. Так, при большом поступлении выделяемой энергии снижается потребление топлива и увеличивается КПД. Но теплота сгорания дизельного топлива напрямую зависит от наличия в составе воды и серы. Поэтому состав дизельного топлива регламентируется. В большинстве случаев теплота сгорания определяется в пределах от 39 200 до 43 300 кДж/кг в зависимости от характеристик используемой при производстве нефти.
17.14: Теплота сгорания — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53882
В целях снижения потребления газа из нефти в обычный бензин часто добавляют этанол. Он имеет более высокое октановое число и горит медленнее, чем обычный бензин. Этот «газохол» широко используется во многих странах. Он производит несколько меньшие выбросы окиси углерода и двуокиси углерода, но увеличивает загрязнение воздуха другими материалами.
Он имеет более высокое октановое число и горит медленнее, чем обычный бензин. Этот «газохол» широко используется во многих странах. Он производит несколько меньшие выбросы окиси углерода и двуокиси углерода, но увеличивает загрязнение воздуха другими материалами.
Молярная теплота сгорания
Многие химические реакции являются реакциями горения. Часто важно знать энергию, выделяемую в такой реакции, чтобы мы могли определить, какое топливо может быть наиболее эффективным для данной цели. Молярная теплота сгорания \(\left( He \right)\) — это теплота, выделяющаяся при полном сгорании одного моля вещества.
Типичные реакции горения включают реакцию углеродсодержащего материала с кислородом с образованием диоксида углерода и воды в качестве продуктов. Если метанол сжечь на воздухе, получим:
\[\ce{CH_3OH} + \ce{O_2} \rightarrow \ce{CO_2} + 2 \ce{H_2O} \: \: \: \: \: He = 890 \: \text{кДж/моль }\nonumber \]
В этом случае один моль кислорода реагирует с одним молем метанола с образованием одного моля углекислого газа и двух молей воды.
Следует отметить, что неорганические вещества также могут вступать в реакцию горения:
\[2 \ce{Mg} + \ce{O_2} \rightarrow 2 \ce{MgO}\nonumber \]
В этом случае вода не образуется и углекислый газ не образуется. Для целей настоящей главы эти реакции обычно не рассматриваются при обсуждении реакций горения. 9\text{o} \text{C} = 46024 \: \text{J} = 46,024 \: \text{kJ}\nonumber \]
Молярная теплота сгорания: \[\frac{46,024 \: \text{ кДж}}{0,0336 \: \text{моль}} = 1370 \: \text{кДж/моль}\номер \]
Шаг 3: Подумайте о своем результате.При сжигании этанола выделяется значительное количество тепла.
Резюме
- Молярная теплота сгорания \(\left( He \right)\) – это теплота, выделяющаяся при полном сгорании одного моля вещества.
- Описаны расчеты с использованием молярной теплоты сгорания.
Эта страница под названием 17.14: Heat of Combustion распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.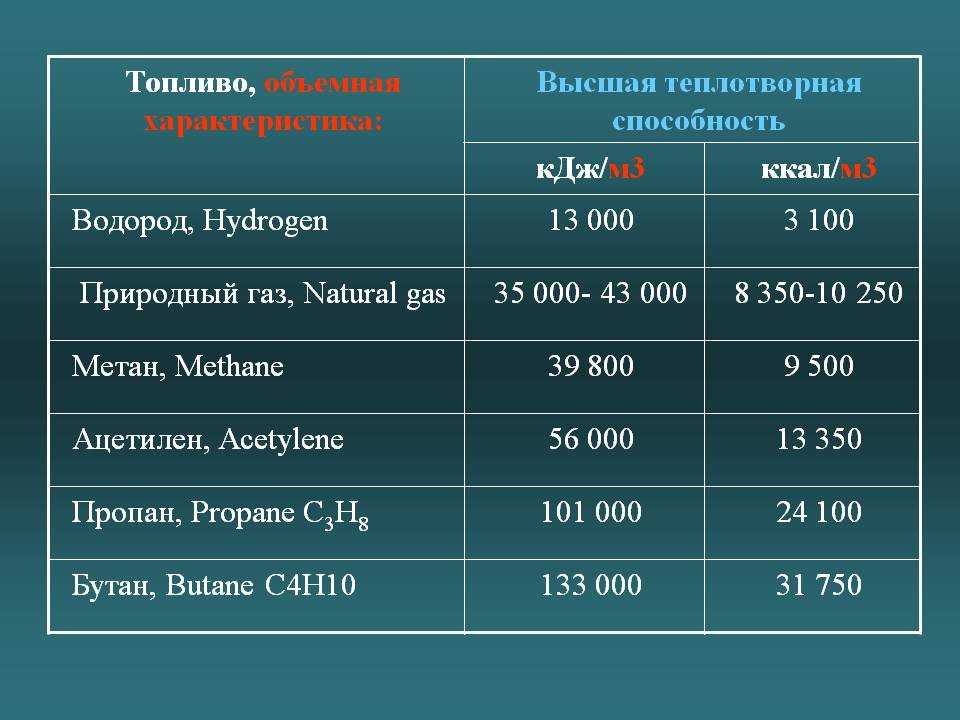
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.
- Теги
- источник@https://flexbooks.
 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
- источник@https://flexbooks.
Теплота сгорания — Бесплатная энциклопедия Simple English Wikipedia
Из бесплатной энциклопедии Simple English Wikipedia
Английский язык, используемый в этой статье или разделе , может быть не всем легко понять . Вы можете помочь Википедии, прочитав Wikipedia:Как писать страницы на простом английском, а затем упростив статью. (апрель 2017 г.) |
Эти куски древесного угля имеют теплотворную способность 7543 ккал/кг. Они горели почти 4 часа.
теплота сгорания , также называемая теплотворная способность или энергетическая ценность вещества – это количество энергии, которое выделяется при сгорании данного количества вещества. Эта энергия выделяется в виде тепла при сгорании вещества в стандартных условиях.
Теплота сгорания ( Δ H ° c ) является мерой количества энергии, выделяемой в виде теплоты ( q ) при сгорании (сгорании) одного моля вещества. Производство тепла означает, что реакция является экзотермическим процессом и выделяет энергию. Теплота сгорания является специальной формой энтальпии реакции, поскольку она измеряется при стандартных условиях и ограничена одним молем исходного материала. Символ (°) показывает, что значение теплоты сгорания получено при стандартных условиях: 25 градусов Цельсия (298,15 Кельвина) и при постоянном давлении. Давление указывается как в одном баре, так и в одной атмосфере в зависимости от источника. [1] [2]
Теплота сгорания также называется энтальпией сгорания, потому что энергия, выделяющаяся в результате реакции сгорания, является результатом изменения общей энтальпии исходного вещества, поскольку оно полностью реагирует с кислородом. Термины теплота сгорания и энтальпия сгорания используются взаимозаменяемо из-за Первого закона термодинамики и соотношений между теплотой при постоянном давлении ( q P ), изменение внутренней энергии (ΔU) и изменение энтальпии (ΔH). [3] [4]
[3] [4]
Уравнение изменения внутренней энергии имеет вид
Δ U = q P — PΔV .
Если уравнение изменить, то
q P = Δ U + P Δ V .
Уравнение изменения энтальпии:
9.Термин V Δ P отменяется, так как нет изменения давления, поэтому
Δ H = Δ U + P Δ V .
Как было сказано ранее,
q P = Δ U + P Δ V .
Следовательно, q P = Δ H .
Измерения теплоты сгорания наиболее распространены при сжигании органических углеводородов, соединений, состоящих из углерода и водорода, но могут включать и другие атомы, содержащиеся в органических соединениях, такие как азот, фосфор, сера и особенно кислород. Значения теплоты сгорания наиболее широко используются для определения того, является ли вещество эффективным источником топлива.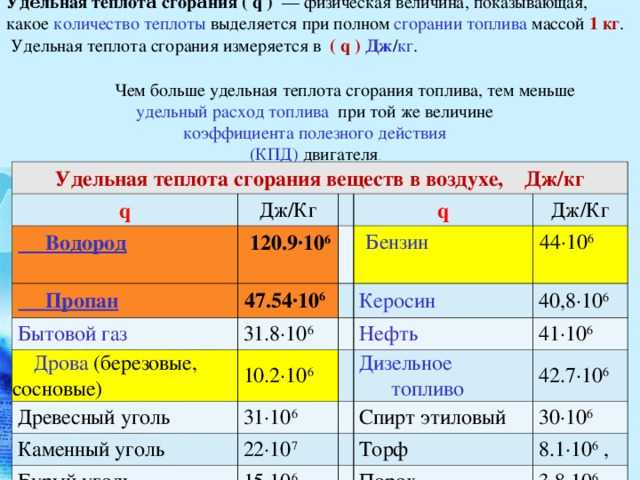 [5] Многие органические соединения можно найти в таблицах теплоты сгорания.
[5] Многие органические соединения можно найти в таблицах теплоты сгорания.
Единицы теплоты сгорания могут варьироваться, но всегда указываются как единицы энергии на моль или на единицу массы или объема в зависимости от метода, используемого для сообщения значений. Для оценки эффективности вещества как топлива удобнее использовать энергию на единицу массы или объема. [5]
Как и при любом горении и многих реакциях окисления, для воспламенения вещества должен присутствовать кислород. Реакции горения проводят с кислородом при постоянном давлении в калориметре. Репрезентативной реакцией горения является реакция метана (CH 4 ) в присутствии кислорода
CH 4 (г) + O 2 (г) → CO 2 + H 2 O(л)
Продуктами реакции горения являются вода и углекислый газ, а реагентами являются кислород и углеводороды. Водный продукт может быть в виде газа или жидкости в зависимости от температуры дожигания.

