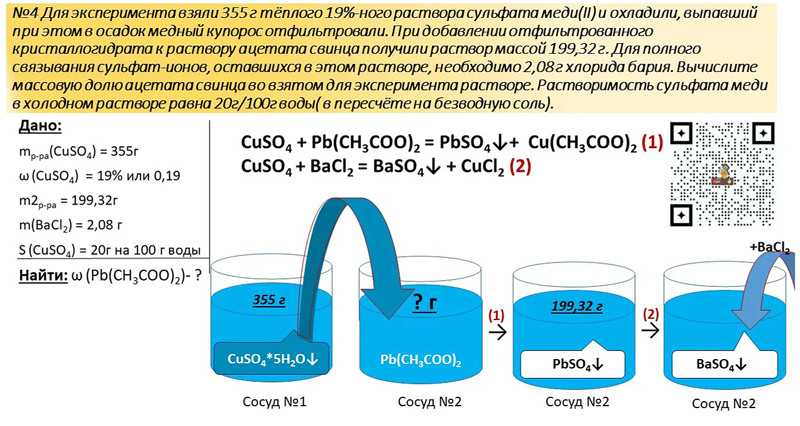
Раздел недели: Скоропись физического, математического, химического и, в целом, научного текста, математические обозначения. Математический, Физический алфавит, Научный алфавит. | ||||||||||||||||||||||||||
| Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление Таблицы DPVA.ru — Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация/ / Рабочие среды/ / Воздух. Атмосфера (хладагент R729) / / Растворимость воздуха в воде. Деаэрация. Закон Генри.
| |||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | ||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator Free xml sitemap generator | |||||||||||||||||||||||||
Какова растворимость газов в воде? — FAQ
Заказать звонок
Поиск по каталогу
- Все
- КИП
- Газовый анализ
Нам известно, что газы могут растворяться в воде. Рыбы дышат растворенным в воде кислородом, морским водорослям растворенный в воде углекислый газ необходим для реакции фотосинтеза – а нам нравится, когда в напитках присутствует шипучий CO2. В данной таблице приводятся коэффициенты растворимости (в литрах газа на литр вода при давлении 1 бар и температуре 20 °C), которые являются критерием растворимости отдельных газов в воде:
| ГАЗ | КОЭФФ.РАСТВОРИМОСТИ |
| Метиламин | 757 |
| Аммиак | 685 |
| Бромистый водород | 532 |
| Хлористый водород | 448 |
| Метилхлорид | 317 |
| Триметиламин | 180 |
| Диметиламин | 118 |
| Диоксид серы | 39 |
| Диметилэфир | 35 |
| Метилмеркаптан | 11 |
| Метилвинилэфир | 3,86 |
| Сероводород | 2,59 |
| Хлор | |
| Этиленоксид | 1,89 |
| Винилхлорид | 1,07 |
| Ацетилен | 1,04 |
| Диоксид углерода | 0,879 |
| Динитроген моноксид | 0,665 |
| Арсин | 0,23 |
| Пропилен | 0,23 |
| 1,3-Бутадиен | 0,202 |
| Этилен | 0,119 |
| Оксид азота | 0,048 |
| Этан | 0,043 |
| Пропан | 0,039 |
| Аргон | 0,034 |
| n-Бутан | 0,034 |
| Метан | 0,033 |
| i-Бутан | 0,033 |
| Кислород | 0,031 |
| Оксид углерода | 0,023 |
| Водород | 0,018 |
| Азот | 0,016 |
| Гелий | 0,0083 |
| Гексафторид серы | 0,0056 |
| Тетрафторметан | 0,0038 |
Растворимость – это такой баланс, при котором количество растворенного газа пропорционально парциальному давлению в газообразной фазе над поверхностью воды.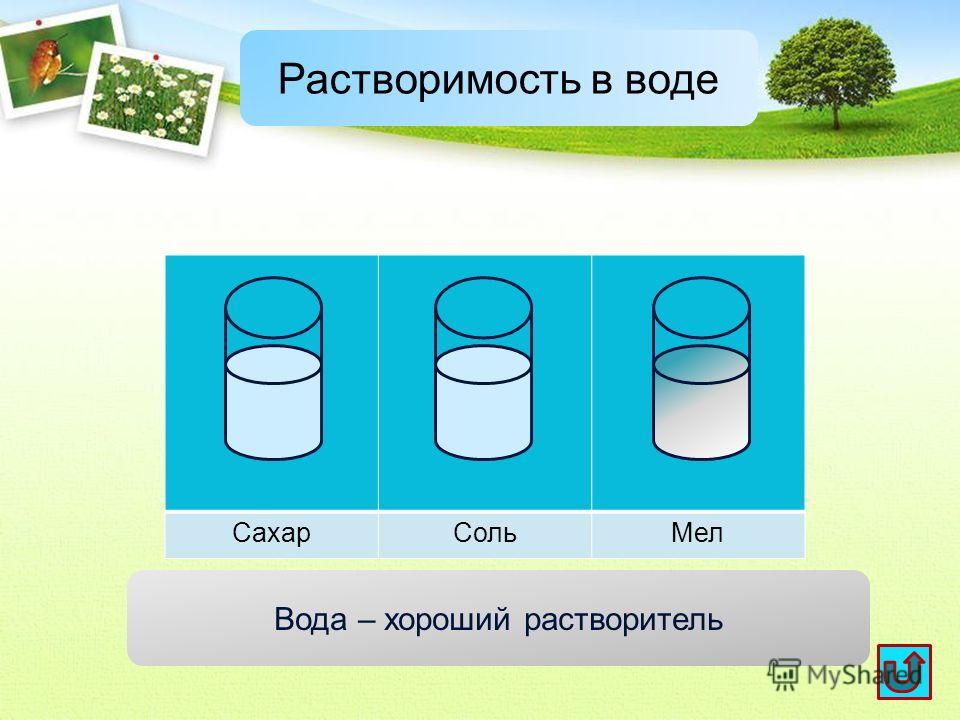
Пример:
20.9 об. % кислорода с атмосферным давлением 1000 мбар создают парциальное давление 0.209 бар O2, таким образом, 1 литр воды содержит 0.031 ∗ 0.209 = 0.00648 литра или 6.5 мл кислорода. Азот (парциальное давление 0.791 бар N2) растворяется хуже, 1 л воды содержит 0.016 ∗ 0.791 = 0.01266 л или 12.7 мл азота. В воде у нас 34 об. % кислорода. Рыбы этим довольны.
Газированная вода производится посредством растворением в воде CO2 под давлением 2 бара. Можно вычислить содержание CO2, оно составляет 0.879 ∗ 2 = 1.75 л CO2, растворенных в 1 л воды.
Как вы видите, некоторые газы растворяются в воде очень быстро и очень эффективно. Именно поэтому в качестве мер безопасности широко распространено использование водяных распылителей и “водяных завес”, например, для снижения угрозы здоровью при выбросах значительных объемов аммиака или HCl.
Помните, что растворимость зависит от температуры. Чем выше температура воды, тем меньше газа можно в ней растворить. По этой причине для растворения загрязняющих газов в воздухе их пропускают сквозь холодную воду, тогда как при нагревании происходит десорбция и высвобождение растворенных в воде газов (часто этому способствует падение давления).
Тонкий слой водяного конденсата на входном отверстии электрохимического сенсора может создать определенные проблемы, растворяя, например, h3S или Nh4, в результате этого уменьшаются показания сенсора.
Отсюда вывод: избегайте образования конденсата!
Темы Газовый анализ
Предыдущая статья
Следующая статья
Напишите нам, мы свяжемся с вами в ближайшее время и поможем подобрать оборудование и ответить на все возникшие у вас вопросы.
Телефон для связи
Представьтесь
Электронная почта
Сообщение или вопрос
Прикрепить файл
Спасибо за обращение!
В ближайщее время с вами
свяжется наш менеджер.
Растворимость воздуха в воде
Количество воздуха, которое может быть растворено в воде, увеличивается с давлением и уменьшается с температурой.
Деаэрация
При нагревании пресной воды начинают образовываться пузырьки воздуха. Вода, очевидно, не может удерживать растворенный воздух с повышенной температурой. При 100 o C (212 o F) вода начинает кипеть — пузырьки образуются от испарившейся воды или пара. Если воду охладить, а затем снова нагреть, пузырьки не появятся, пока вода не закипит. Вода деаэрированный .
Solubility Ratio
Solubility of air in water can be expressed as a solubility ratio:
S a = m a / m w (1)
where
S a = коэффициент растворимости0013 Закон Генри — «количество воздуха, растворенного в жидкости, пропорционально давлению в системе» — может быть выражен как:где
c= растворимость растворенного газа
k H = константа пропорциональности, зависящая от природы газа и растворителя
p г = парциальное давление газа (Па, psi)
Растворимость кислорода в воде больше, чем растворимость азота. Воздух, растворенный в воде, содержит примерно 35,6% кислорода по сравнению с 21% в воздухе.
Воздух, растворенный в воде, содержит примерно 35,6% кислорода по сравнению с 21% в воздухе.
Solubility of Air in Water
Solubility of air in water — expressed as ratio of absorbed air volume to water volume :
| Solubility (v air /v water ) | ||||||
|---|---|---|---|---|---|---|
| Температура ( o F) | Манометрическое давление (psig) | |||||
| 0 | 20 | 40 | 60 | 80 | 100 | |
| 40 | 0.0258 | 0.0613 | 0.0967 | 0.1321 | 0.1676 | 0.2030 |
| 50 | 0.0223 | 0.0529 | 0.0836 | 0.1143 | 0.1449 | 0.1756 |
| 60 | 0. 0197 0197 | 0.0469 | 0.0742 | 0.1014 | 0.1296 | 0.1559 |
| 70 | 0.0177 | 0.0423 | 0.0669 | 0.0916 | 0.1162 | 0.1408 |
| 80 | 0.0161 | 0.0387 | 0.0614 | 0.0840 | 0,1067 | 0,1293 |
| 90 | 0,0147 | 0,0358 | 0,0569 3 12 933 | 0.1201 | ||
| 100 | 0.0136 | 0.0334 | 0.0532 | 0.0730 | 0.0928 | 0.1126 |
| 110 | 0.0126 | 0.0314 | 0.0501 | 0.0689 | 0.0877 | 0.1065 |
| 120 | 0.0117 | 0.0296 | 0.0475 | 0.0654 | 0.0833 | 0.1012 |
| 130 | 0. 0107 0107 | 0.0280 | 0.0452 | 0.0624 | 0.0796 | 0.0968 |
| 140 | 0.0098 | 0.0265 | 0.0432 | 0.0598 | 0.0765 | 0.0931 |
| 150 | 0.0089 | 0.0251 | 0.0413 | 0.0574 | 0.0736 | 0.0898 |
| 160 | 0.0079 | 0.0237 | 0.0395 | 0.0553 | 0.0711 | 0.0869 |
| 170 | 0.0068 | 0.0223 | 0.0378 | 0.0534 | 0.0689 | 0.0844 |
| 180 | 0.0055 | 0,0208 | 0,0361 | 0,0514 | 0,0667 | 0,0820 |
| 190 190 | 01030,02 | 0.0344 | 0.0496 | 0.0647 | 0.0799 | |
| 200 | 0. 0024 0024 | 0.0175 | 0.0326 | 0.0477 | 0.0628 | 0.0779 |
| 210 | 0.0004 | 0.0155 | 0.0306 | 0,0457 | 0,0607 | 0,0758 |
0002 Количество воздуха, растворенного в воде —
масс воздуха к объему/массе воды — можно рассчитать по закону Генри.Константы Генри Лоу при температуре системы 25 O C (77 O F)
- — O 2 : 756,7 Атм/(моль/литр)
- 40404040404040404040404040404040404040404040404040404040404040404040440440440440440440440404404404404404404404440444044404440444044404440444044404440444044404440444044446.7 -n 2 : 1600 атм/(моль/литр)
Молярный вес
- Кислород — O 2 : 31,9988 g/mol
- Nitrogen — N 2 : 28.0134 g/mol
Partial fraction in Air
- Oxygen — O 2 : ~ 0.
 21
21 - Nitrogen — N 2 : ~ 0,79
Кислород, растворенный в воде при атмосферном давлении, можно рассчитать как: 31,9988 г/моль)
= 0,0089 г/литр
~ 0,0089 г/кг
Азот растворен в воде при атмосферном давлении. ) 0.79 / (1600 atm/(mol/litre)) (28.0134 g/mol)
= 0.0138 g/litre
~ 0.0138 g/kg
Since воздух в основном состоит из азота и кислорода — количество воздуха, растворенного в воде, можно рассчитать как:
963 9003. in water for some other pressures at temperature 25 o C (77 o F) can be summarized to:C A = (0,0089 г/литр) + (0,0138 г/литр)
= 0,0227 г/литр
~ 0,023 G/KG
| Pressure, abs (atm) | 1 | 2 | 3 | 4 | 5 | 6 |
| Dissolved Air in Water (25 o C) (g/kg) | 0. 023 023 | 0.045 | 0.068 | 0.091 | 0.114 | 0.136 |
Кислород, растворенный в пресной воде
Деаэрация
Для максимальной деаэрации воду необходимо нагреть до 212 o F (100 o C) при атмосферном давлении Это распространено в паровых системах, где свежая вода подается в систему через обогреваемую деаэрационную колонну в верхней части резервуара для сбора конденсата.
Также принято устанавливать деаэрационные устройства на горячих сторонах теплообменников в системах распределения тепла, чтобы вытеснить растворенный воздух из системы.
Внимание! Поскольку максимальная деаэрация ограничена минимальным статическим давлением и максимальной температурой в системе, наилучший результат деаэрации достигается в местах на самом горячем и верхнем уровнях системы и/или на стороне всасывания насосов.
Могут ли газы растворяться в воде? | Глава 5: Молекула воды и растворение
Тебе это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Спасибо!
Урок 5.8
Ключевые понятия
- Газы могут растворяться в воде.
- Растворение газа в воде зависит от взаимодействия между молекулами газа и молекулами воды.
- Количество газа, которое может быть растворено в воде, зависит от температуры воды.
- В холодной воде может раствориться больше газа, чем в горячей.
Резюме
Учащиеся будут наблюдать растворенный углекислый газ (CO 2 ) в бутылке газированной воды. Они помогут разработать эксперимент для сравнения количества CO 2 , который остается в холодной газировке, по сравнению с более теплой газировкой.
Задача
Учащиеся смогут объяснить на молекулярном уровне, как газ растворяется в воде. Они также смогут объяснить, почему газ выходит из раствора быстрее в теплой воде, чем в холодной.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки.
Демонстрационные материалы
Неоткрытая литровая бутылка газированной воды, которая также будет использоваться в упражнении.
Материалы для каждой группы
- Клубная газировка
- 3 прозрачных пластиковых стаканчика
- 1 М&М
- Очиститель труб
- Горячая вода
- Холодная вода
- 2 контейнера для деликатесов (в которые легко помещаются чашки)
Покажите учащимся пузырьки, которые появляются, когда открывается новая бутылка газировки.
Напомните учащимся, что они видели, что некоторые твердые и жидкие вещества могут растворяться в воде (глава 5, уроки 5 и 7).
Спросите студентов:
- Как вы думаете, могут ли газы растворяться в воде?
- Идея растворения газа может показаться студентам странной, но эта демонстрация поможет им понять, что газы могут растворяться в воде.
Материалы
Неоткрытая 1-литровая бутылка газированной воды
Подготовка учителя
Снимите этикетку с 1-литровой бутылки газированной воды.
Спросите студентов:
- Чем бутылка с газированной водой отличается от обычной бутылки с водой?
- Студенты, вероятно, скажут, что в газированной воде есть пузырьки.
- Вы видите пузырьки в газированной воде?
- Они пока ничего не должны увидеть.
Процедура
- Очень медленно отвинтите крышку флакона.
- Подождите несколько секунд, чтобы учащиеся увидели пузыри.
Плотно закройте бутылку крышкой.
Ожидаемые результаты
Когда крышка ослабнет, в газировке появится много пузырьков, которые поднимутся через воду на поверхность, где и лопнут. Когда крышка затянута, пузырьков будет меньше.
Спросите студентов:
- Что вы заметили, когда я открыл, а затем закрыл бутылку газировки?
- Пузыри появлялись только при открытии бутылки.
 Пузырьки перестали образовываться, когда крышка флакона была затянута.
Пузырьки перестали образовываться, когда крышка флакона была затянута. - Какой газ образует эти пузыри?
- Углекислый газ (CO 2 )
- Где находился CO 2 до того, как бутылка была открыта?
- Углекислый газ растворился в воде.
Объясните, что газированная вода состоит из углекислого газа, растворенного в воде.
Расскажите учащимся, что на заводе по производству газированных напитков в холодную воду под высоким давлением добавляется углекислый газ для получения газированной воды. Давление заставляет больше газа растворяться, чем обычно.
Спроецировать изображение CO 2 Молекула.
Укажите, что молекула двуокиси углерода имеет небольшой отрицательный заряд вблизи кислорода и небольшой положительный заряд вблизи углерода. CO2 растворим, потому что молекулы воды притягиваются к этим полярным областям. Связь между углеродом и кислородом не такая полярная, как связь между водородом и кислородом, но она достаточно полярна, чтобы углекислый газ мог растворяться в воде.
Спроецируйте изображение CO 2 Растворенный в воде.
Объясните, что в газированной воде молекулы углекислого газа тщательно перемешиваются и растворяются в воде. Это похоже на молекулы сахарозы, ионы натрия и хлорида из соли или молекулы изопропилового спирта, которые учащиеся растворяли в воде в предыдущих заданиях этой главы. Укажите, что при растворении молекулы CO 2 не похожи на крошечные пузырьки газа, смешанные с водой. Вместо отдельных молекул CO 2 окружены молекулами воды.
Сообщите учащимся, что хотя CO 2 растворяется, молекулы воды не притягиваются так сильно, как такие вещества, как соль или сахар. Из-за этих более слабых притяжений молекулы CO 2 относительно легко выходят из раствора. Вот почему сода становится безвкусной, если ее оставить без крышки слишком долго.
Раздайте каждому учащемуся лист с заданиями.
Учащиеся описывают план своего эксперимента, записывают свои наблюдения и отвечают на вопросы о задании в листе задания.
 Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.Предложите учащимся добавить предметы в газированную воду, чтобы проверить, смогут ли они получить углекислый газ из раствора.
Спросите студентов:
- Помимо встряхивания газировки или оставления ее открытой, существуют ли другие способы выделения углекислого газа из газированной воды?
- Скажите учащимся, что в газировку можно поместить предметы, которые могут вызвать выделение углекислого газа из газировки.
Вопрос для изучения
Как можно выделить из раствора углекислый газ?
Материалы для каждой группы
- Газированная вода в прозрачном пластиковом стаканчике
- 2 прозрачных пластиковых стаканчика
- М&М
- Очиститель труб
Подготовка учителя
Непосредственно перед занятием используйте бутылку с газированной водой из демонстрации, чтобы налить около ¾ чашки газированной воды в прозрачный пластиковый стаканчик для каждой группы.

Процедура
- Равномерно распределите содовую по 3 прозрачным пластиковым стаканчикам. Отодвиньте две из этих чашек в сторону, чтобы использовать их позже.
Поместите ершик в соду и наблюдайте.
- Поместите M&M в газировку и наблюдайте.
Ожидаемые результаты
На трубоочистителе образуются пузыри. Пузырьки также образуются на M&M и поднимаются на поверхность.
Спросите студентов:
- Откуда взялись пузырьки газа, которые вы наблюдали?
- В воде растворялись молекулы углекислого газа.
- Куда делся углекислый газ, растворенный в воде?
- Пузырьки углекислого газа поднялись на поверхность и лопнули, выпустив углекислый газ в воздух.
Объясните, что предметы, помещенные в газировку, имели крошечные неровности, где собирались молекулы углекислого газа. Когда достаточное количество молекул собралось вместе в определенной области, они превратились в пузырь.
 Когда этот пузырь, менее плотный, чем окружающая его вода, стал достаточно большим, он всплыл на поверхность и лопнул, выпустив в воздух углекислый газ.
Когда этот пузырь, менее плотный, чем окружающая его вода, стал достаточно большим, он всплыл на поверхность и лопнул, выпустив в воздух углекислый газ.Спросите студентов:
- Когда вы пили газировку через соломинку, вы могли заметить, что на внешней стороне соломинки образуются пузырьки. Теперь, когда вы выполнили это задание, как вы думаете, почему на соломинке образуются эти пузыри?
- Несмотря на то, что солома выглядит гладкой, на ней также есть крошечные неровности, где собираются молекулы углекислого газа. Когда их накапливается достаточное количество, они превращаются в пузыри углекислого газа.
Обсудите, как выяснить, влияет ли температура на скорость выхода газа из газированной воды.
Спросите студентов:
- Вы ожидаете, что углекислый газ будет лучше растворяться в горячей или холодной воде? Подсказка: Сода-поп хранится в холодильнике после того, как его открыли.
- Учащиеся узнают ответ на этот вопрос, выполняя следующее задание.

- Как бы вы поставили эксперимент, чтобы выяснить, в какой воде лучше растворяется углекислый газ: в нагретой или в охлажденной воде?
- Учащиеся должны понимать, что им потребуется две чашки газированной воды. Затем им нужно будет нагреть один и охладить другой. Один простой способ нагреть и охладить чашки — это использовать ванну с горячей или холодной водой, как описано в процедуре.
- Если из газировки выйдет больше углекислого газа, будет ли на поверхности появляться больше или меньше пузырьков?
- На поверхности появится больше пузырей.
- Если в растворе останется больше углекислого газа, будет ли на поверхности появляться больше или меньше пузырьков?
- На поверхности будет меньше пузырьков.
Сделайте вывод, что учащиеся могут сравнить скорость выхода углекислого газа или его пребывания в растворе, сравнив количество пузырьков, которые, как они видят, поднимаются на поверхность и лопаются. Чем больше пузырьков поднимается и лопается, тем больше газа выходит из раствора.
 Чем меньше пузырьков поднимается и лопается, тем больше газа остается в растворе.
Чем меньше пузырьков поднимается и лопается, тем больше газа остается в растворе.Предложите учащимся нагреть и охладить 2 чашки газированной воды, чтобы выяснить, влияет ли температура на растворимость углекислого газа.
Вопрос для изучения
Углекислый газ лучше растворяется в нагретой или охлажденной воде?
Материалы для каждой группы
- Газированная вода в 2 прозрачных пластиковых стаканах
- Горячая вода (около 50 °C)
- Холодная вода (около 5 °C)
- 2 контейнера для деликатесов (в которые легко помещаются чашки)
Процедура
- Принесите две чашки газированной воды, которые вы отложили ранее.
- Наполните один пустой контейнер для гастрономов примерно на ⅓ объема ледяной водой, а другой примерно на ⅓ — горячей водопроводной водой.
- Поместите каждую чашку с газированной водой в холодную и горячую воду, как показано на рисунке.
- Следите за поверхностью газировки в каждой чашке газированной воды.

Ожидаемые результаты
Больше пузырьков образуется и поднимается на поверхность в газированной воде, помещенной в горячую воду.
Обсудите наблюдения учащихся.
Учащиеся должны понимать, что растворенный газ выходит из раствора быстрее, когда газировка теплая, чем когда она холодная. Верно и обратное: растворенный газ лучше растворяется в холодной газировке.
Спросите студентов:
- Диоксид углерода лучше растворяется в горячей или в холодной воде?
- Углекислый газ лучше растворяется в холодной воде.
- Откуда ты знаешь?
- Из газировки, помещенной в горячую воду, выделяется больше газа.
- Основываясь на том, что вы наблюдали в этом эксперименте, как вы думаете, почему люди хранят открытую газировку в холодильнике?
- Так как при более низкой температуре выделяется меньше углекислого газа, хранение газированных напитков в холодильнике предотвращает их опустошение.

Объясните, почему углекислый газ выделяется из горячей воды быстрее, чем из холодной.
Напомните учащимся, что углекислый газ готов выйти из газированной воды независимо от температуры воды. Это связано с тем, что молекулы газа и молекулы воды несколько притягиваются друг к другу, но не очень сильно. Все, что вам нужно сделать, это оставить бутылку газировки открытой, и углекислый газ выйдет сам по себе, и ваша газировка станет пресной. Нагрев газировки увеличивает движение молекул воды и углекислого газа, делая их соединения еще слабее и позволяя газу выходить еще быстрее.
Примечание. Даже газировка, которую мы называем «безалкогольной», содержит немного углекислого газа, потому что некоторое количество CO 2 из воздуха растворяется в воде.
Помогите учащимся связать свои наблюдения с графиком растворимости углекислого газа в воде.
Спроектируйте изображение График растворимости CO 2 .

Посмотрите на график, чтобы увидеть, как концентрация углекислого газа в воде изменяется в зависимости от температуры.
Спросите студентов:
- При повышении температуры углекислый газ становится более растворимым в воде или менее растворимым в воде?
- Углекислый газ менее растворим при повышении температуры воды.
- Этот график соответствует или не соответствует вашим наблюдениям? Объяснять.
- Этот график соответствует наблюдениям учащихся в задании. По мере нагревания газированной воды из раствора выходило больше CO 2 . Поскольку осталось больше газа, меньше растворилось в более теплой воде.
- Что говорят вам графики о растворимости диоксида углерода по сравнению с сахарозой при повышении температуры?
- Кривая, показывающая растворимость углекислого газа, понижается при повышении температуры воды, а кривая, показывающая растворимость сахарозы, повышается при повышении температуры воды. В горячей воде растворяется больше сахарозы, чем в холодной.
 Но углекислого газа в холодной воде может раствориться больше, чем в горячей.
Но углекислого газа в холодной воде может раствориться больше, чем в горячей.
Соотнесите опыт учащихся с растворимостью углекислого газа и растворимостью кислорода.
Расскажите учащимся, что есть еще один распространенный пример газа, растворенного в воде. Вода, в которой живут рыбы и другие водные существа, содержит растворенный газообразный кислород. Эти существа используют свои жабры, чтобы получать кислород из воды, чтобы остаться в живых. Как и растворимость углекислого газа в воде, растворимость кислорода уменьшается с повышением температуры.
Спросите студентов:
- В течение долгого жаркого лета можно заметить рыбу, глотающую воздух у поверхности пруда. Как вы думаете, почему рыбы вот так всплывают на поверхность, а не дышат растворенным в воде кислородом, как обычно?
- Как и двуокись углерода, концентрация растворенного кислорода также зависит от температуры. Холодная вода может содержать больше растворенного кислорода, чем теплая.
 Зимой и ранней весной, когда температура воды низкая, концентрация растворенного кислорода высока. Летом и ранней осенью при высокой температуре воды концентрация растворенного кислорода ниже.
Зимой и ранней весной, когда температура воды низкая, концентрация растворенного кислорода высока. Летом и ранней осенью при высокой температуре воды концентрация растворенного кислорода ниже. - Электростанции, работающие на угле, нагревают воду, чтобы вращать турбины для производства электроэнергии. После использования вода охлаждается, а затем возвращается в реку или озеро, из которого она была получена. Почему важно охлаждать воду перед возвратом в реку?
- Растворенные газы, такие как кислород для рыб и углекислый газ для водных растений, улетучились бы, если бы возвращаемая вода была горячей. Прохладная вода помогает растворять газы, в которых нуждаются рыбы, другие водные существа и подводные растения.
Предложите учащимся понаблюдать и объяснить, что происходит, когда леденцы Mentos бросают в бутылку диетической колы.
Спросите студентов:
- Кто-нибудь когда-нибудь видел демонстрацию диетической колы и Mentos?
- Если учащиеся видели это, попросите их описать действие.
 Целую пачку мятных конфет Mentos бросают в 2-литровую бутылку газированного напитка, обычно диетической колы. Газировка вылетает из бутылки с большой силой и взлетает высоко в воздух.
Целую пачку мятных конфет Mentos бросают в 2-литровую бутылку газированного напитка, обычно диетической колы. Газировка вылетает из бутылки с большой силой и взлетает высоко в воздух.
Проецируйте видео Mentos и Diet Coke Demo.
Если вы хотите провести эту демонстрацию, она должна быть сделана снаружи. Инструкции можно найти на http://crazysciencedemos.com.
Напомните учащимся, что средство для чистки труб и M&M, которые они добавляли в газированную воду, вызвали выделение CO 2 из раствора. Mentos и диетическая кола работают одинаково. На микроскопическом уровне поверхность мяты шероховатая со множеством крошечных бугорков и ямок. Когда конфету добавляют в газировку, молекулы углекислого газа прилипают к этим крошечным точкам, называемым точками зародышеобразования. В этих областях собирается больше молекул углекислого газа, образуя пузырьки. Пузырьки углекислого газа образуются быстро и растут во всех направлениях, но могут выйти только из верхней части бутылки.


 Коэффициенты Генри для воздуха.
Коэффициенты Генри для воздуха. (Существует, кроме того, масса практических методик деаэрации воды, не связанных с нагреванием. В целом — деаэрация — это удаление растворенного воздуха из жидкости.)
(Существует, кроме того, масса практических методик деаэрации воды, не связанных с нагреванием. В целом — деаэрация — это удаление растворенного воздуха из жидкости.) Воздух, растворенный в воде содержит приблизительно 35,6 % кислорода по сравнению с 21% долей в обычном воздухе.
Воздух, растворенный в воде содержит приблизительно 35,6 % кислорода по сравнению с 21% долей в обычном воздухе. 79 / (1600 атм/(моль/л)) (28.0134 г/моль) = 0.0138 г/л ~ 0.0138 г/кг
79 / (1600 атм/(моль/л)) (28.0134 г/моль) = 0.0138 г/л ~ 0.0138 г/кг Растворимость кислорода в пресной воде мг/л при 1 атм в зависимости от температуры.
Деаэрация — основные принципы и правила установки деаэраторов.
Растворимость кислорода в пресной воде мг/л при 1 атм в зависимости от температуры.
Деаэрация — основные принципы и правила установки деаэраторов.
 Введите свой запрос:
Введите свой запрос: