Глава 13. Газовые законы
Задачи на газовые законы часто предлагаются школьникам на едином государственном экзамене. Для решения этих задач вполне достаточно знать уравнение состояния идеального газа (закон Клапейрона-Менделеева) и уметь использовать его алгебраически и геометрически (для построения графиков зависимости одних параметров газа от других) в простейших ситуациях. Кроме того, нужно понимать, как описываются смеси идеальных газов (закон Дальтона).
Уравнение, связывающее параметры газа друг с другом, называется уравнением состояния. Для идеального газа, взаимодействие молекул которого мало, уравнение состояния имеет вид
(13.1) |
где — давление газа, — концентрация молекул газа (число молекул в единице объема), — постоянная Больцмана, — абсолютная (в шкале Кельвина) температура. Учитывая, что , где — число молекул газа, — объем сосуда, в котором находится газ (часто говорят объем газа), получим из (13.
(13.2) |
Число молекул можно связать с количеством вещества газа : , где — число Авогадро. Поэтому формулу (13.2) можно переписать в виде
(13.2) |
где произведение постоянных Авогадро и Больцмана обозначено как . Постоянная = 8,31 Дж/(К•моль) называется универсальной газовой постоянной. Количество вещества газа можно также выразить через его массу и молярную массу этого газа
(13.3) |
С учетом (13.3) закон (13.2) можно переписать и в таком виде
(13.4) |
Уравнение состояния идеального газа (13.1)-(13.4), которое также называется уравнением (или законом) Клапейрона-Менделеева, позволяет связывать параметры идеального газа и проследить за их изменением в тех или иных процессах.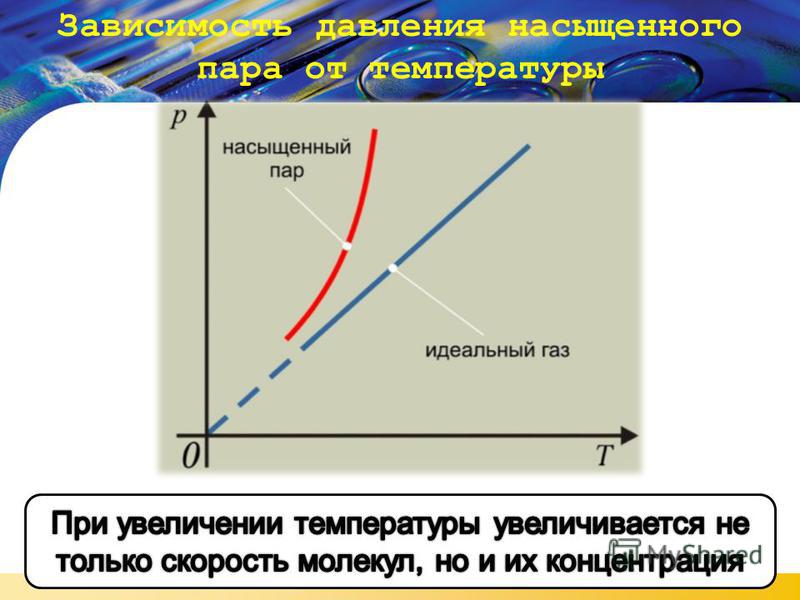
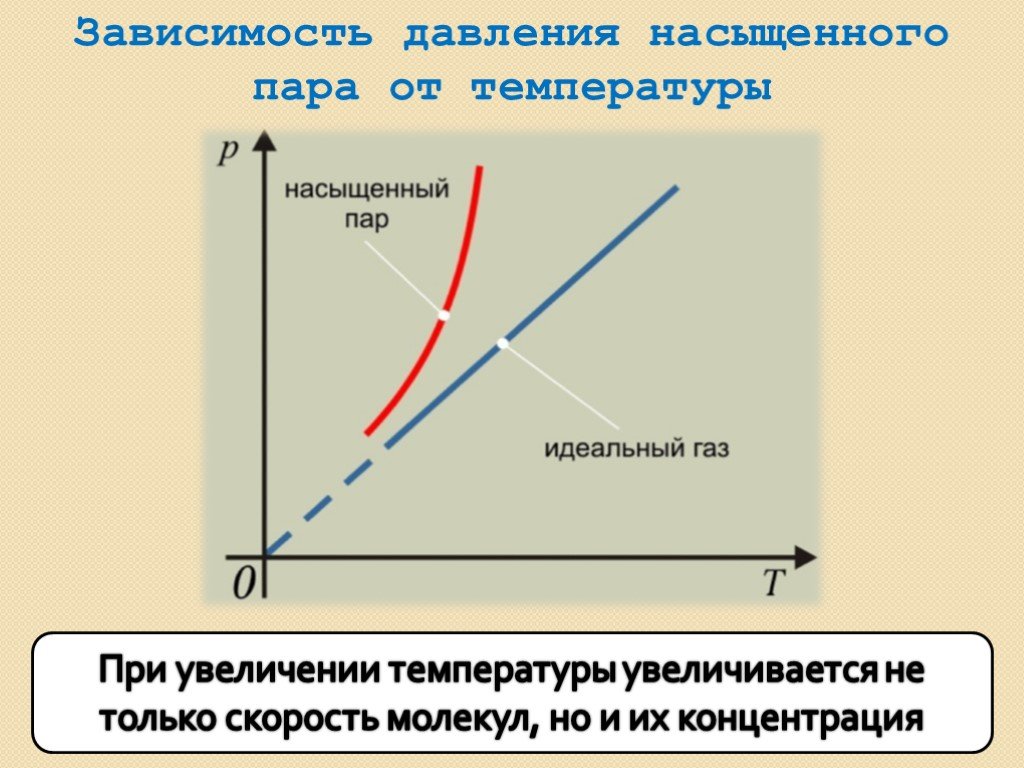
В школьном курсе физики рассматриваются три изопроцесса, в которых один из трех параметров газа (давление, температура и объем) не изменяется. В изобарическом процессе не изменяется давление газа, в изотермическом — температура, в изохорическом — объем. Изопроцессам отвечают следующие графики зависимости давления от объема, давления от температуры, объема от температуры.
Для изобарического процесса
Первые два графика очевидны. Последний получается так. Из закона Клапейрона-Менделеева следует, что зависимость объема от температуры при постоянном давлении имеет вид
(13.5) |
где — постоянная. Графиком функции (13.5) является прямая, продолжение которой проходит через начало координат.
Для изохорического процесса
Второй график следует из соотношения
(13. |
где — постоянная при постоянном объеме.
Для изотермического процесса
Первый график следует из закона Клапейрона-Менделеева, который при постоянной температуре газа можно привести к виду
(13.7) |
где — постоянная. Отсюда следует, что графиком зависимости от в изотермическом процессе является гипербола.
Важнейшее свойство уравнения состояния идеального газа (13.1)-(13.4) заключается в том, что «индивидуальность» газа никак не проявляется в этих законах — единственный параметр собственно газа, входящий в уравнение состояния, — это число молекул. Например, 1 моль гелия и 1 моль азота, находящиеся в одинаковых объемах и имеющие одинаковые температуры, оказывают одинаковое давление. Отсюда следует, что и давление смеси идеальных газов определяется суммарным числом молекул всех компонент смеси:
(13. |
где — число молекул первой, второй, третьей и т.д. компонент смеси, — постоянная Больцмана, — абсолютная температура смеси, — объем сосуда. Величины , имеющие смысл давления каждой компоненты смеси при условии, что она имела бы такую же температуру и занимала бы весь объем, называются парциальными давлениями компонент. Закон (13.8) называется законом Дальтона. Рассмотрим теперь в рамках этих законов предложенные выше задачи.
В задаче 13.1.1 из уравнения состояния в форме (13.1), получаем для давления в конце процесса :
т.е. давление газа увеличилось в 6 раз (ответ 1).
Применяя закон Клапейрона-Менделеева (13.2) к первому и второму газам (задача 13.1.2), получаем
где — искомый объем. Сравнивая первую и вторую формулы, заключаем, что (ответ 1).
Закон Клапейрона-Менделеева для газа в начальном и конечном состояниях (задача 13.1.3) дает
где — неизвестная температура. Из сравнения этих формул получаем , т.е. температуру газа в сосуде нужно повысить вдвое (ответ 2).
Из закона Клапейрона-Менделеева для начального и конечного состояний газа в задаче 13.1.4 имеем
Отсюда , т.е. количество вещества газа в сосуде увеличилось в 1,25 раза (ответ 3).
Первым, кто понял, почему жидкость поднимается вместе с трубкой (задача 13.1.5), и почему «природа боится пустоты» (Аристотель), но только до определенного предела, был знаменитый итальянский физик, современник Г. Галилея Э. Торричелли. Давайте рассмотрим рассуждения Торричелли подробно. Основная идея Торричелли заключалась в том, что атмосферный воздух оказывает давление на все поверхности, с которыми он контактирует. В равновесии жидкость занимает такое положение, чтобы все воздействия на каждый ее элемент компенсировались. Если бы трубка была открыта (см. левый рисунок), то жидкость не поднялась бы в трубке. Действительно, в этом случае на бесконечно малый элемент жидкости в трубке около поверхности (выделен на рисунке) действовали бы сила со стороны атмосферного воздуха в трубке, направленная вниз. С другой стороны, атмосферный воздух действует и на остальную поверхность жидкости, и это воздействие благодаря закону Паскаля передается выделенному элементу жидкости в трубке снизу. Таким образом, воздействие воздуха на поверхность жидкости в трубке и на свободную поверхность жидкости компенсируют друг друга, если уровень жидкости в трубке совпадает с уровнем жидкости в остальном сосуде. Если же мы поднимаем трубку, выпустив из нее воздух, на рассматриваемый элемент жидкости воздух сверху не действует (его нет в трубке), поэтому воздействие воздуха на свободную поверхность жидкости приведет к тому, что жидкость войдет в трубку и заполнит ее.
В равновесии жидкость занимает такое положение, чтобы все воздействия на каждый ее элемент компенсировались. Если бы трубка была открыта (см. левый рисунок), то жидкость не поднялась бы в трубке. Действительно, в этом случае на бесконечно малый элемент жидкости в трубке около поверхности (выделен на рисунке) действовали бы сила со стороны атмосферного воздуха в трубке, направленная вниз. С другой стороны, атмосферный воздух действует и на остальную поверхность жидкости, и это воздействие благодаря закону Паскаля передается выделенному элементу жидкости в трубке снизу. Таким образом, воздействие воздуха на поверхность жидкости в трубке и на свободную поверхность жидкости компенсируют друг друга, если уровень жидкости в трубке совпадает с уровнем жидкости в остальном сосуде. Если же мы поднимаем трубку, выпустив из нее воздух, на рассматриваемый элемент жидкости воздух сверху не действует (его нет в трубке), поэтому воздействие воздуха на свободную поверхность жидкости приведет к тому, что жидкость войдет в трубку и заполнит ее.
Сравнивая графики процессов 1, 2, 3 и 4, данные в условии задачи 13.1.6, с графиками изопроцессов, приведенными во введении к настоящей главе, заключаем, что: процесс 1 — изотермический, 2 — изохорический, 3 — изобарический. В процесс 4 меняются и давление, и объем, и температура газа (ответ  |
В изотермическом процессе давление зависит от объема как ; на диаграмме этот процесс изображается гиперболой. Поэтому изотермическими являются процессы 1 и 3 (задача 13.1.7), но в процессе 1 объем газа убывает. Следовательно, изотермическим расширением является процесс 3 (ответ 3). |
Изохорическим охлаждением в задаче 13.1.8 является процесс 4 (см. рисунок) В двух последних задачах этого варианта нужно с помощью закона Клапейрона-Менделеева вычислить один из параметров газа, если даны остальные параметры. В задаче 13.1.9 из закона Клапейрона-Менделеева |
получим
(ответ 1).
В задаче 13.1.10 при вычислениях следует не забыть перевести температуру газа в Кельвины. Из закона Клапейрона-Менделеева находим
Из закона Клапейрона-Менделеева находим
(ответ 1).
Из уравнения состояния в форме (13.2) следует, что при одинаковых объемах и температурах давление идеального газа определяется только полным числом молекул. Поэтому отношение давления водорода и гелия в задаче 13.2.1 равно 2 (ответ 2).
Поскольку перегородка в задаче 13.2.2 подвижная и находится в равновесии, давления газа в отсеках сосуда слева и справа от перегородки равны. Применяя к ним при этом условии закон Клапейрона-Менделеева, получим
для гелия |
для азота |
где температуры и массы газов по условию одинаковы. Деля эти уравнения друг на друга, находим отношение объемов частей сосуда
(ответ 4).
Если бы точки, отвечающие состояниям 1 и 2 в задаче 13. 2.3, лежали на одной прямой, продолжение которой проходит через начало координат, то эти состояния принадлежали бы одной и той же изохоре, и, следовательно, объем газа в этих состояниях был одинаковым (см. формулу (13.6)). Поэтому для сравнения объемов этих состояний построим изохоры, проходящие через точки 1 и 2, и сравним отвечающие им объемы (см. рисунок; изохоры, проходящие через точки 1 и 2, показаны пунктиром).
2.3, лежали на одной прямой, продолжение которой проходит через начало координат, то эти состояния принадлежали бы одной и той же изохоре, и, следовательно, объем газа в этих состояниях был одинаковым (см. формулу (13.6)). Поэтому для сравнения объемов этих состояний построим изохоры, проходящие через точки 1 и 2, и сравним отвечающие им объемы (см. рисунок; изохоры, проходящие через точки 1 и 2, показаны пунктиром).
Из формулы (13.6) следует, что чем больше объем, тем меньше коэффициент перед в зависимости (13.6), и, следовательно, меньше наклон соответствующей изохоры к оси температур. Поэтому изохоре 1 отвечает больший объем, чем изохоре 2, и, следовательно, объем газа в процессе 1-2 уменьшается (ответ 2).
Аналогичные рассуждения в задаче 13.2.4 показывают, что наибольшему давлению отвечает изобара, проходящая через точку (поскольку соответствующая прямая имеет наименьший наклон к оси температур; см. рисунок ниже). Поэтому правильный ответ в этой задаче — 3.
В закон Клапейрона-Менделеева входит абсолютная температура газа, поэтому данные в задаче 13.2.5 значения нужно перевести в Кельвины. В результате для отношения давлений газа в конечном и начальном состояниях получаем
(ответ 4).
Как следует из опыта, при приведении тел в тепловой контакт выравниваются их температуры. Это же касается и частей одного тела или даже компонент смеси газов (задача 13.2.6). Поэтому температуры компонент смеси будут одинаковы (ответ 1). Что касается парциальных давлений, плотностей или концентрации компонент смеси, то их значения зависят от количества молекул каждой компоненты смеси и могут быть различны.
Парциальное давление компонент смеси – это давление, которое оказывают только молекулы каждой компоненты. Как следует из формулы (13.8) парциальное давление любой компоненты можно найти, применяя только к ней закон Клапейрона-Менделеева и считая, что она имеет такую же температуру, как и вся смесь, и занимает такай же объем, как и вся смесь газов.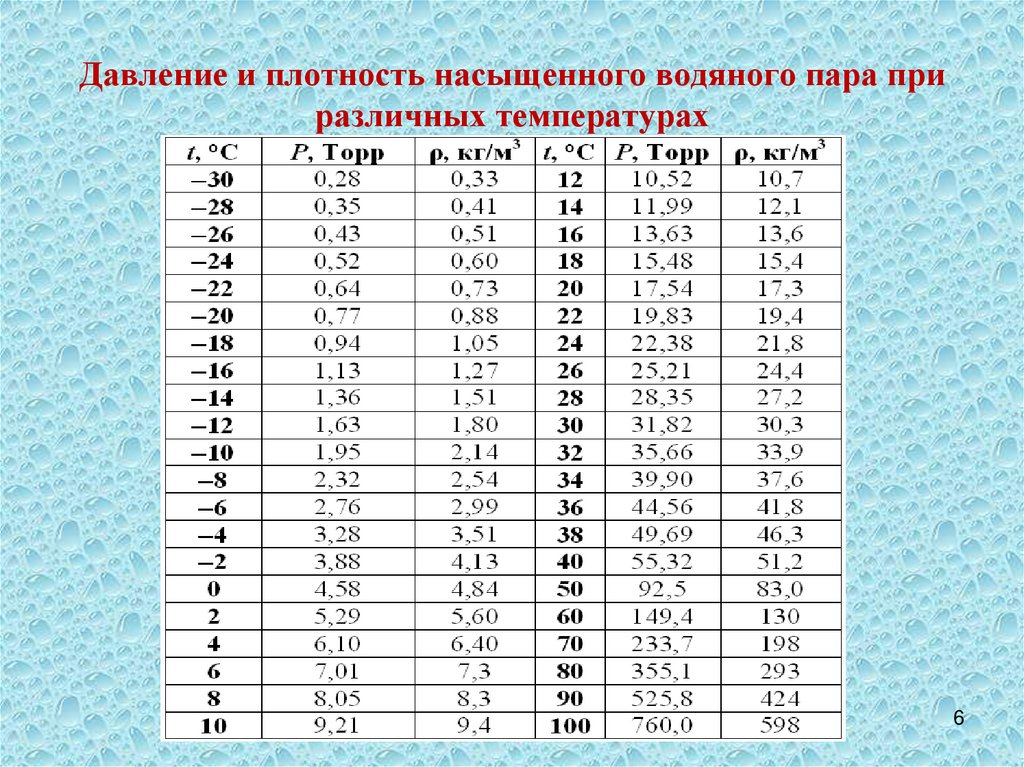 Поэтому отношение парциальных давлений отдельных компонент смеси равно отношению количеств вещества (или числа молекул) этих компонент. Поэтому для отношения парциальных давлений углекислого газа и гелия в сосуде в задаче 13.2.7 имеем (ответ 2).
Поэтому отношение парциальных давлений отдельных компонент смеси равно отношению количеств вещества (или числа молекул) этих компонент. Поэтому для отношения парциальных давлений углекислого газа и гелия в сосуде в задаче 13.2.7 имеем (ответ 2).
Как следует из закона Дальтона, давление смеси газов определяется полным количеством молекул в ней. Поэтому для анализа изменения давления смеси газов при протекании в ней химической реакции (задача 13.2.8) необходимо исследовать изменение числа молекул. Гелий не участвует в химической реакции — один моль гелия был и в начальном, и в конечном состоянии смеси. С озоном происходила реакция
т.е. из двух молекул озона в результате реакции получились три молекулы кислорода. Поэтому два моля озона превратились в три моля кислорода, и общее количество вещества смеси стало равно четырем молям. Поэтому давление смеси увеличивается в 4/3 раза (ответ 2).
Поскольку объемы и температуры газов одинаковы (задача 13.2.9), для сравнения их давлений необходимо сравнить число молекул в них. По условию в одном сосуде находится один моль азота, в другом 1 г водорода (т.е. половина моля) и 3 • 1023 молекул гелия (тоже половина моля). Поэтому и в одном и в другом сосуде находятся одинаковые количества молекул, и, следовательно, давление газов в них одинаково (ответ 3).
Плотность газа (задача 13.2.10) можно найти из следующей цепочки формул
(ответ 4). Здесь — масса газа, — масса одной молекулы газа.
ОглавлениеВВЕДЕНИЕ§ 1.2. Физика и техника. § 1.3. Понятие о величине и измерении. Физические величины. § 1.4. Прямое и косвенное измерения. § 1.5. Звездное небо и его видимое вращение. § 1.6. Угловые измерения на небе. 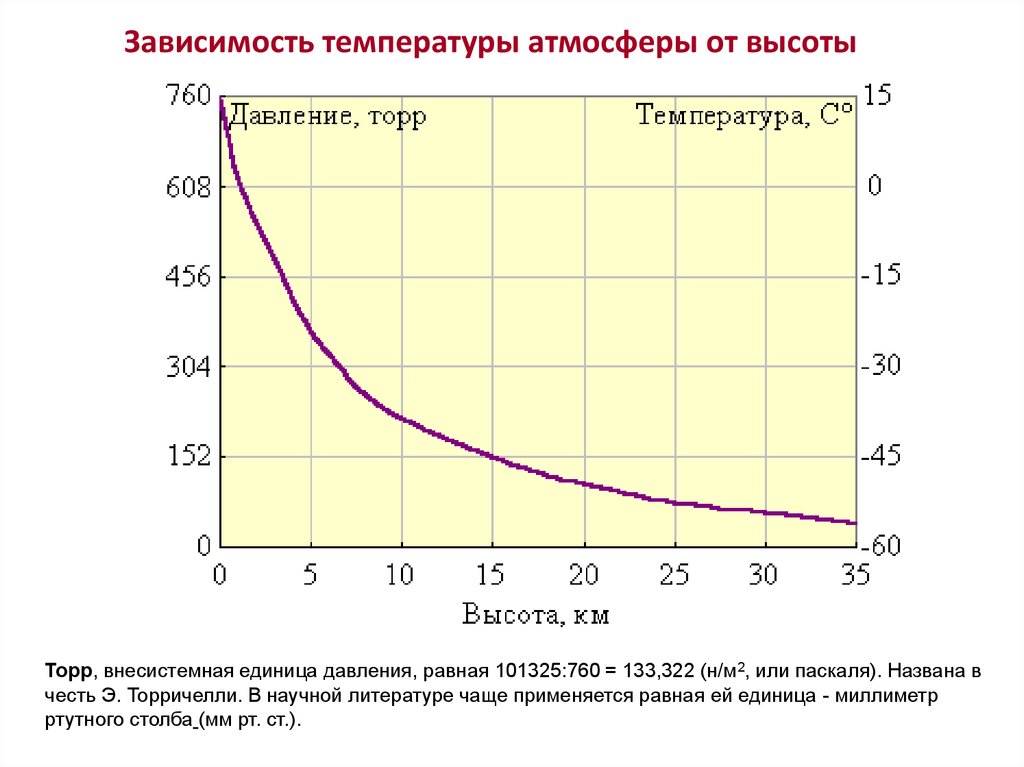 § 1.7. Определение расстояний до небесных тел на основе измерения параллаксов. § 1.8. Основные единицы времени и их связь с движением Земли. § 1.9. Правило вывода единиц физических величин из формул. Международная система единиц СИ. § 1.10. Плотность вещества. Раздел I. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕПЛОТА Глава 2. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ СТРОЕНИЯ ВЕЩЕСТВА § 2.2. Диффузия. § 2.3. Силы молекулярного взаимодействия. § 2.4. Кинетическая и потенциальная энергия молекул. § 2.5. Агрегатное состояние вещества. § 2.6. Понятие о температуре и внутренней энергии тела. Глава 3. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗООБРАЗНОГО СОСТОЯНИЯ ВЕЩЕСТВА § 3.2. Броуновское движение. § 3.3. Измерение скорости движения молекул газа. Опыт Штерна. § 3.4. Распределение молекул по скоростям их хаотического движения. § 3.5. Размеры и массы молекул и атомов. § 3.6. Постоянная Авогадро и постоянная Лошмидта. § 3.7. Число столкновений и длина свободного пробега молекул в газе. 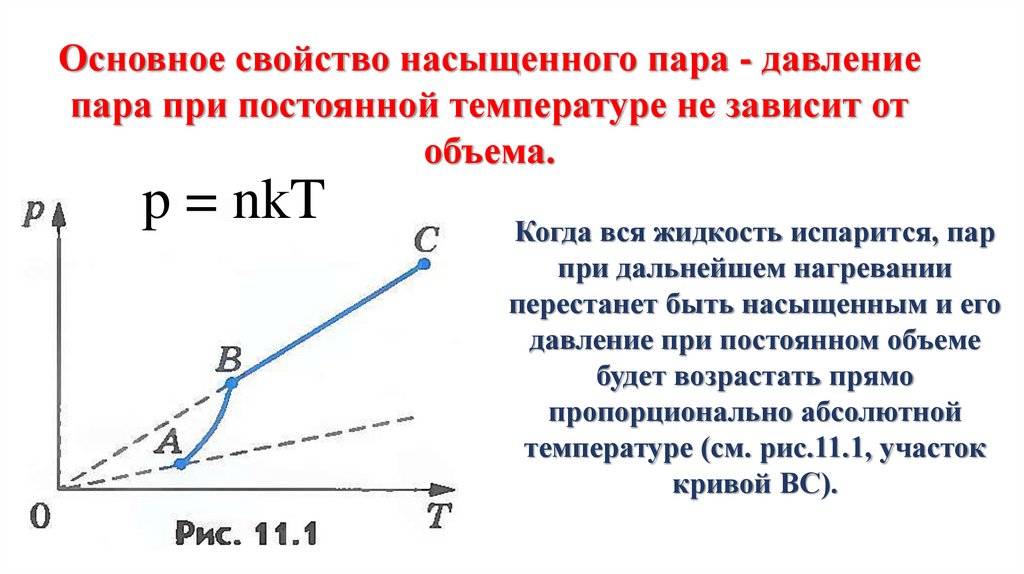 § 3.8. Давление газа. Манометры. § 3.9. Понятие вакуума. § 3.10. Межзвездный газ. Глава 4. ИДЕАЛЬНЫЙ ГАЗ. АБСОЛЮТНАЯ ТЕМПЕРАТУРА И ЕЕ СВЯЗЬ С ЭНЕРГИЕЙ МОЛЕКУЛ ГАЗА § 4.2. Основное уравнение молекулярно-кинетической теории газов. § 4.3. Зависимость давления газа от температуры при постоянном объеме. § 4.4. Абсолютный нуль. § 4.5. Термодинамическая шкала температур. Абсолютная температура. § 4.6. Связь между температурой и кинетической энергией молекул газа. Постоянная Больцмана. Глава 5. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА § 5.2. Объединенный газовый закон. Приведение объема газа к нормальным условиям. § 5.3. Молярная газовая постоянная. Определение числового значения постоянной Больцмана. § 5.4. Уравнение Клапейрона — Менделеева. Плотность газа. § 5.5. Зависимость средней квадратичной скорости молекул газа от температуры. § 5.6. Изохорический процесс. § 5.7. Изобарический процесс. § 5.8. Изотермический процесс. § 5.  9. Внутренняя энергия идеального газа. 9. Внутренняя энергия идеального газа.§ 5.10. Работа газа при изменении его объема. Физический смысл молярной газовой постоянной. Глава 6. ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ. ЗАКОН СОХРАНЕНИЯ И ПРЕВРАЩЕНИЯ ЭНЕРГИИ § 6.2. Теплообмен. § 6.3. Виды теплообмена. § 6.4. Изменение внутренней энергии при нагревании и охлаждении. § 6.5. Уравнение теплового баланса при теплообмене. § 6.6. Подсчет теплоты, выделяемой при сжигании топлива. К. п. д. нагревателя. § 6.7. Изменение внутренней энергии при выполнении механической работы. Опыт Джоуля. § 6.8. Закон сохранения и превращения энергии в механике. § 6.9. Закон сохранения и превращения энергии в механических и тепловых процессах. § 6.10. Первое начало термодинамики. § 6.11. Применение первого начала термодинамики к изопроцессам в идеальном газе. § 6.12. Адиабатный процесс. § 6.13. Понятие о строении Солнца и звезд. Глава 7. ПЕРЕХОД ВЕЩЕСТВА ИЗ ЖИДКОГО СОСТОЯНИЯ В ГАЗООБРАЗНОЕ И ОБРАТНО § 7.  2. Испарение. 2. Испарение.§ 7.3. Теплота парообразования. Глава 8. СВОЙСТВА ПАРОВ. КИПЕНИЕ. КРИТИЧЕСКОЕ СОСТОЯНИЕ ВЕЩЕСТВА § 8.2. Свойства паров, насыщающих пространство. § 8.3. Свойства паров, не насыщающих пространство. § 8.4. Процесс кипения жидкости. § 8.5. Зависимость температуры кипения жидкости от внешнего давления. Точка кипения. § 8.6. Уравнение теплового баланса при парообразовании и конденсации. § 8.7. Перегретый пар и его использование в технике. § 8.8. Критическое состояние вещества. § 8.9. Сжижение газов и использование жидких газов в технике. Глава 9. ВОДЯНОЙ ПАР В АТМОСФЕРЕ § 9.2. Абсолютная и относительная влажность воздуха. Точка росы. § 9.3. Приборы для определения влажности воздуха. § 9.4. Понятие об атмосферах планет. Глава 10. СВОЙСТВА ЖИДКОСТЕЙ § 10.2. Поверхностный слой жидкости. § 10.3. Энергия поверхностного слоя жидкости. Поверхностное натяжение. § 10.4. Сила поверхностного натяжения. § 10.5. Смачивание.  Краевой угол. Краевой угол.§ 10.6. Мениск. Давление, создаваемое искривленной поверхностью жидкости. § 10.7. Капиллярность. Капиллярные явления в природе и технике. § 10.8. Понятие о вязкости среды. Ламинарное течение жидкости. § 10.9. Закон Ньютона для внутреннего трения. Динамическая вязкость. § 10.10. Аморфные вещества. Глава 11. СВОЙСТВА ТВЕРДЫХ ТЕЛ. ДЕФОРМАЦИИ § 11.2. Анизотропия кристаллов. Пространственная решетка и ее дефекты. § 11.3. Виды кристаллических структур. § 11.4. Виды деформаций. § 11.5. Механическое напряжение. § 11.6. Упругость, пластичность, хрупкость и твердость. § 11.7. Закон Гука. Модуль упругости. § 11.8. Энергия упруго деформированного тела. Глава 12. ПЛАВЛЕНИЕ И КРИСТАЛЛИЗАЦИЯ. СУБЛИМАЦИЯ. ДИАГРАММА СОСТОЯНИЙ ВЕЩЕСТВА § 12.2. Удельная теплота плавления. § 12.3. Изменение объема и плотности вещества при плавлении и отвердевании. § 12.4. Зависимость температуры и теплоты плавления от давления. Точка плавления.  § 12.5. Уравнение теплового баланса при плавлении и кристаллизации. § 12.6. Растворы и сплавы. Охлаждающие смеси. § 12.7. Испарение твердых тел (сублимация). § 12.8. Диаграмма состоянии вещества. Тройная точка. Глава 13. ТЕПЛОВОЕ РАСШИРЕНИЕ ТЕЛ § 13.2. Линейное расширение твердых тел при нагревании. § 13.3. Объемное расширение тел при нагревании. Зависимость плотности вещества от температуры. § 13.4. Особенности теплового расширения твердых тел. § 13.5. Некоторые особенности теплового расширения жидкостей. § 13.6. Значение теплового расширения тел в природе и технике. Раздел II. ОСНОВЫ ЭЛЕКТРОДИНАМИКИ Глава 14. ЭЛЕКТРИЧЕСКИЕ ЗАРЯДЫ. ЗАКОН КУЛОНА § 14.2. Явления, подтверждающие сложное строение атома. § 14.3. Опыты Резерфорда. Ядерная модель строения атома. § 14.4. Понятие о строении атомов различных химических элементов. § 14.5. Электризация при соприкосновении незаряженных тел. § 14.6. Сила взаимодействия электрических зарядов.  Закон Кулона. Закон Кулона.§ 14.7. Диэлектрическая проницаемость среды. § 14.8. Международная система единиц СИ в электричестве. Электрическая постоянная. § 14.9. Электроскоп. Глава 15. ЭЛЕКТРИЧЕСКОЕ ПОЛЕ § 15.2. Напряженность электрического поля. § 15.3. Линии напряженности электрического поля. § 15.4. Однородное поле. Поверхностная плотность заряда. § 15.5. Работа электрического поля при перемещении заряда. Потенциальная энергия заряда. § 15.6. Потенциал. Разность потенциалов и напряжение. Эквипотенциальные поверхности. § 15.7. Связь между напряженностью поля и напряжением. Градиент потенциала. § 15.8. Проводник в электрическом поле. § 15.9. Электрометр. § 15.10. Диэлектрик в электрическом поле. Поляризация диэлектрика. § 15.11. Понятие о сегнетоэлектриках. § 15.12. Пьезоэлектрический эффект. § 15.13. Электроемкость проводника. § 15.14. Условия, от которых зависит электроемкость проводника. § 15.15. Конденсаторы. § 15.16.  Соединение конденсаторов в батарею. Соединение конденсаторов в батарею.§ 15.17. Энергия заряженного конденсатора. Плотность энергии электрического поля. § 15.18. Опыт Милликена. Глава 16. ЭЛЕКТРИЧЕСКИЙ ТОК В МЕТАЛЛАХ. ЗАКОНЫ ПОСТОЯННОГО ТОКА § 16.2. Сила тока и плотность тока в проводнике. § 16.3. Замкнутая электрическая цепь. § 16.4. Электродвижущая сила источника электрической энергии. § 16.5. Внешняя и внутренняя части цепи. § 16.6. Закон Ома для участка цепи без э. д. с. Сопротивление проводника. Падение напряжения. § 16.7. Зависимость сопротивления от материала, длины и площади поперечного сечения проводника. § 16.8. Зависимость сопротивления от температуры. § 16.9. Сверхпроводимость. § 16.10. Эквивалентное сопротивление. § 16.11. Последовательное соединение потребителей энергии тока. § 16.12. Параллельное соединение потребителей энергии тока § 16.13. Закон Ома для всей цепи. § 16.14. Соединение одинаковых источников электрической энергии в батарею. § 16.  15. Закон Ома для участка цепи с э. д. с. и для всей цепи при нескольких э. д. с. 15. Закон Ома для участка цепи с э. д. с. и для всей цепи при нескольких э. д. с.Глава 17. РАБОТА, МОЩНОСТЬ И ТЕПЛОВОЕ ДЕЙСТВИЕ ЭЛЕКТРИЧЕСКОГО ТОКА § 17.2. Мощность электрического тока. § 17.3. Тепловое действие электрического тока. Закон Джоуля — Ленца. § 17.4. Короткое замыкание. Практическое применение теплового действия тока. Глава 18. ТЕРМОЭЛЕКТРИЧЕСКИЕ ЯВЛЕНИЯ § 18.2. Контактная разность потенциалов. § 18.3. Термоэлектродвижущая сила. § 18.4. Явление Пельтье. § 18.5. Применение термоэлектрических явлений в науке и технике. Глава 19. ЭЛЕКТРИЧЕСКИЙ ТОК В ЭЛЕКТРОЛИТАХ § 19.2. Электролиз. § 19.3. Электролиз, сопровождающийся растворением анода. § 19.4. Количество вещества, выделяющегося при электролизе. Первый закон Фарадея. § 19.5. Второй закон Фарадея. Определение заряда иона. § 19.6. Использование электролиза в технике. § 19.7. Гальванические элементы. § 19.8. Аккумуляторы. § 19.9. Применение гальванических элементов и аккумуляторов в технике.  Явление электрокоррозии. Явление электрокоррозии.Глава 20. ЭЛЕКТРИЧЕСКИЙ ТОК В ГАЗАХ И В ВАКУУМЕ § 20.2. Зависимость силы тока в газе от напряжения. § 20.3. Электрический разряд в газе при атмосферном давлении. § 20.4. Электрический разряд в разреженных газах. Газосветные трубки и лампы дневного света. § 20.5. Излучение и поглощение энергии атомом. § 20.6. Катодные лучи. § 20.7. Понятие о плазме. § 20.8. Электрический ток в вакууме. § 20.9. Двухэлектродная лампа (диод). § 20.10. Трехэлектродная лампа (триод). § 20.11. Электронно-лучевая трубка. Глава 21. ЭЛЕКТРИЧЕСКИЙ ТОК В ПОЛУПРОВОДНИКАХ § 21.2. Чистые (беспримесные) полупроводники. Термисторы. § 21.3. Примесные полупроводники. § 21.4. Электронно-дырочный переход. § 21.5. Полупроводниковый диод. § 21.6. Полупроводниковый триод (транзистор). Глава 22. ЭЛЕКТРОМАГНЕТИЗМ § 22.2. Магнитное поле как особый вид материи. § 22.3. Магниты. § 22.4. Линии магнитной индукции. Понятие о вихревом поле.  § 22.5. Магнитное поле прямолинейного тока, кругового тока и соленоида. § 22.6. Сравнение магнитных свойств соленоида и постоянного магнита. § 22.7. Сила взаимодействия параллельных токов. Магнитная проницаемость среды. § 22.8. Определение ампера. Магнитная постоянная. § 22.9. Действие магнитного поля на прямолинейный проводник с током. § 22.10. Однородное магнитное поле. § 22.11. Магнитный момент контура с током. § 22.12. Работа при перемещении проводника с током в магнитном поле. Магнитный поток. § 22.13. Индукция магнитного поля, создаваемая в веществе проводниками с током различной формы. § 22.14. Напряженность магнитного поля и ее связь с индукцией и магнитной проницаемостью среды. § 22.15. Парамагнитные, диамагнитные и ферромагнитные вещества. § 22.16. Намагничивание ферромагнетиков. Электромагнит. § 22.17. Работа и устройство амперметра и вольтметра. § 22.18. Сила Лоренца. Движение заряда в магнитном поле. § 22.19. Постоянное и переменное магнитные поля.  Глава 23. ЭЛЕКТРОМАГНИТНАЯ ИНДУКЦИЯ § 23.2. Явление электромагнитной индукции. § 23.3. Э. д. с. индукции, возникающая в прямолинейном проводнике при его движении в магнитном поле. Правило правой руки. § 23.4. Опыты Фарадея. § 23.5. Закон Ленца для электромагнитной индукции. Объяснение диамагнитных явлений. § 23.6. Величина э. д. с. индукции. § 23.7. Вихревое электрическое поле и его связь с магнитным полем. § 23.8. Вихревые токи. § 23.9. Роль магнитных полей в явлениях, происходящих на Солнце и в космосе. § 23.10. Явление самоиндукции. Э. д. с. самоиндукции. § 23.11. Энергия магнитного поля. Раздел III. КОЛЕБАНИЯ И ВОЛНЫ Глава 24. МЕХАНИЧЕСКИЕ КОЛЕБАНИЯ И ВОЛНЫ § 24.2. Условия возникновения колебаний. § 24.3. Классификация колебательных движений тела в зависимости от действующей на него силы. § 24.4. Параметры колебательного движения. § 24.5. Величины, характеризующие мгновенное состояние колеблющейся точки. § 24.6.  Гармоническое колебание. Гармоническое колебание.§ 24.7. Уравнение гармонического колебания и его график. § 24.8. Математический маятник. § 24.9. Законы колебания математического маятника. Формула маятника. § 24.10. Физический маятник. § 24.11. Практические применения маятников. § 24.12. Упругие колебания. Превращение энергии при колебательном движении. § 24.13. Распространение колебательного движения в упругой среде. § 24.14. Перенос энергии бегущей волной. § 24.15. Поперечные и продольные волны. § 24.16. Волна и луч. Длина волны. § 24.17. Скорость распространения волн и ее связь с длиной волны и периодом (частотой) колебаний. § 24.18. Сложение колебаний, происходящих по одной прямой. § 24.19. Отражение волн. § 24.20. Стоячие волны. § 24.21. Интерференция волн. § 24.22. Сложение колебаний с кратными частотами. Разложение сложного колебания на гармонические составляющие. § 24.23. Вынужденные колебания. Механический резонанс и его роль в технике.  Глава 25. ЗВУК И УЛЬТРАЗВУК § 25.3. Громкость и интенсивность звука. § 25.4. Высота тона и тембр звука. § 25.5. Интерференция звуковых волн. § 25.6. Отражение и поглощение звука. § 25.7. Звуковой резонанс. § 25.8. Ультразвук и его применение в технике. Глава 26. ПЕРЕМЕННЫЙ ТОК § 26.2. Понятие об устройстве индукционных генераторов. § 26.3. Действующие значения э. д. с., напряжения и силы переменного тока. § 26.4. Индуктивность и емкость в цепи переменного тока. § 26.5. Преобразование переменного тока. Трансформатор. § 26.6. Индукционная катушка. § 26.7. Трехфазный ток. § 26.8. Получение, передача и распределение электрической энергии в народном хозяйстве СССР. Глава 27. ЭЛЕКТРОМАГНИТНЫЕ КОЛЕБАНИЯ И ВОЛНЫ § 27.2. Затухающие электромагнитные колебания. Электрический резонанс. § 27.3. Получение незатухающих колебаний с помощью лампового генератора. § 27.4. Токи высокой частоты и их применение. § 27.5. Электромагнитное поле как особый вид материи. 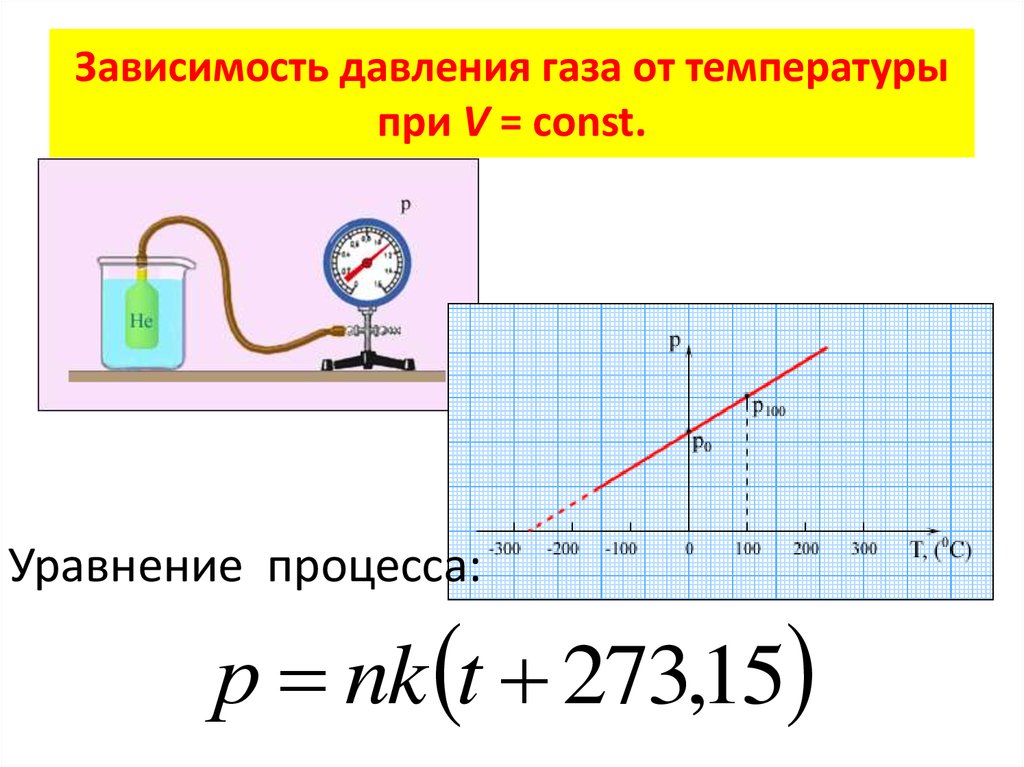 § 27.6. Открытый колебательный контур. Излучение. § 27.7. Электромагнитные волны. Скорость их распространения. § 27.8. Опыты Герца. § 27.9. Изобретение радио А С. Поповым. Радиотелеграфная связь. § 27.10. Радиотелефонная связь. Амплитудная модуляция. § 27.11. Устройство простейшего лампового радиоприемника с усилителем низкой частоты. § 27.12. Понятие о радиолокации. Раздел IV. ОПТИКА. ОСНОВЫ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ Глава 28. ПРИРОДА СВЕТА. РАСПРОСТРАНЕНИЕ СВЕТА § 28.2. Понятие об электромагнитной теории света. Диапазон световых волн. § 28.3. Понятие о квантовой теории света. Постоянная Планка. § 28.4. Источники света. § 28.5. Принцип Гюйгенса. Световые лучи. § 28.6. Скорость распространения света в вакууме. Опыт Майкельсона. § 28.7. Скорость распространения света в различных средах. Глава 29. ОТРАЖЕНИЕ И ПРЕЛОМЛЕНИЕ СВЕТА § 29.2. Законы отражения света. § 29.3. Зеркальное и диффузное отражение. Плоское зеркало. § 29.  4. Сферические зеркала. 4. Сферические зеркала.§ 29.5. Построение изображений, получаемых с помощью сферических зеркал. Формула сферического зеркала. § 29.6. Законы преломления света. § 29.7. Абсолютный показатель преломления и его связь с относительным показателем преломления. § 29.8. Полное отражение света. Предельный угол. § 29.9. Прохождение света через пластинку с параллельными гранями и через трехгранную призму. Призма с полным отражением. Глава 30. ЛИНЗЫ. ПОЛУЧЕНИЕ ИЗОБРАЖЕНИЙ С ПОМОЩЬЮ ЛИНЗ § 30.2. Главные фокусы и фокальные плоскости линзы. § 30.3. Оптическая сила линзы. § 30.4. Построение изображения светящейся точки, расположенной на главной оптической оси линзы. § 30.5. Вывод формулы для сопряжеппых точек тонкой линзы. § 30.6. Построение изображения светящейся точки, расположенной на побочной оптической оси линзы. § 30.7. Построение изображений предмета, создаваемых линзой. § 30.8. Линейное увеличение, полученное с помощью линзы. § 30.9. Недостатки линз.  Выясним, какие существенные недостатки встречаются у линз. Выясним, какие существенные недостатки встречаются у линз.Глава 31. ОПТИЧЕСКИЕ ПРИБОРЫ. ГЛАЗ § 31.2. Фотографический аппарат. § 31.3. Глаз как оптическая система. § 31.4, Длительность зрительного ощущения. § 31.5. Угол зрения. § 31.6. Расстояние наилучшего зрения. Оптические дефекты глаза. § 31.7. Увеличение оптического прибора. Лупа. § 31.8. Микроскоп. § 31.9. Труба Кеплера. Телескопы. § 31.10. Труба Галилея. Бинокль. Глава 32. ЯВЛЕНИЯ, ОБЪЯСНЯЕМЫЕ ВОЛНОВЫМИ СВОЙСТВАМИ СВЕТА § 32.2. Цвета тонких пленок. § 32.3. Интерференция в клинообразной пленке. Кольца Ньютона. § 32.4. Интерференция света в природе и технике. § 32.5. Дифракция света. § 32.6. Дифракционная решетка и дифракционный спектр. Измерение длины световой волны. § 32.7. Поляризация волн. § 32.8. Поляризация света. Поляроиды. § 32.9. Поляризация при отражении и преломлении света. Глава 33. ФОТОМЕТРИЯ § 33.2. Световой поток. § 33.3. Сила света.  Единицы силы света и светового потока. Единицы силы света и светового потока.§ 33.4. Освещенность. § 33.5. Яркость. § 33.6. Законы освещенности. § 33.7. Сравнение силы света двух источников. Фотометр. Люксметр. Глава 34. ИЗЛУЧЕНИЕ И СПЕКТРЫ. РЕНТГЕНОВСКИЕ ЛУЧИ § 34.2. Разложение белого света призмой. Сплошной спектр. § 34.3. Сложение спектральных цветов. Дополнительные цвета. § 34.4. Цвета тел. § 34.5. Ультрафиолетовая и инфракрасная части спектра. § 34.6. Роль ультрафиолетовых и инфракрасных лучей в природе. Их применение в технике. § 34.7. Приборы для получения и исследования спектров. § 34.8. Виды спектров. § 34.9. Спектры поглощения газов. Опыты Кирхгофа. § 34.10. Закон теплового излучения Кирхгофа. § 34.11. Законы теплового излучения Стефана — Больцмана, Вина, Планка. § 34.12. Спектры Солнца и звезд. Их связь с температурой. § 34.13. Спектральный анализ. § 34.14. Понятие о принципе Доплера. § 34.15. Рентгеновские лучи и их практическое применение.  § 34.16. Шкала электромагнитных волн. § 34.17. Виды космического излучения. Глава 35. ЯВЛЕНИЯ, ОБЪЯСНЯЕМЫЕ КВАНТОВЫМИ СВОЙСТВАМИ ИЗЛУЧЕНИЯ § 35.2. Давление световых лучей. Опыты П. Н. Лебедева. § 35.3. Тепловое действие света. § 35.4. Химическое действие света. § 35.5. Использование химического действия света при фотографировании. Понятие о квантовой природе химического действия излучения. § 35.6. Внешний фотоэлектрический эффект. Опыты Столетова. § 35.7. Законы внешнего фотоэффекта. § 35.8. Объяснение фотоэффекта на основе квантовой теории. § 35.9. Фотоэлементы с внешним фотоэффектом. § 35.10. Внутренний фотоэффект. § 35.11. Фотосопротивления. § 35.12. Фотоэлементы с внутренним фотоэффектом. § 35.13. Использование фотоэлементов в науке и технике. § 35.14. Понятие о телевидении. § 35.15. Понятие о теории Бора. Строение атома водорода. § 35.16. Излучение и поглощение энергии атомами. § 35.17. Явление люминесценции.  § 35.18. Понятие о квантовых генераторах. Глава 36. ОСНОВЫ СПЕЦИАЛЬНОЙ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ § 36.2. Экспериментальные основы специальной теории относительности Эйнштейна. Постулаты Эйнштейна. § 36.3. Понятие одновременности. § 36.4. Относительность понятий длины и промежутка времени § 36.5. Теорема сложения скоростей Эйнштейна. § 36.6. Масса и импульс в специальной теории относительности. § 36.7. Связь между массой и энергией. Уравнение Эйнштейна. § 36.8. Связь между импульсом и энергией. Импульс и энергия фотонов. Раздел V. ФИЗИКА АТОМНОГО ЯДРА Глава 37. СТРОЕНИЕ АТОМНОГО ЯДРА § 37.2. Радиоактивность. § 37.3. Понятие о превращении химических элементов. § 37.4. Понятие об энергии и проникающей способности радиоактивного излучения. § 37.5. Эффект Вавилова — Черенкова. § 37.6. Открытие искусственного превращения атомных ядер. § 37.7. Открытие нейтрона. § 37.8. Состав атомного ядра. Запись ядерных реакций. § 37.  9. Изотопы. 9. Изотопы.§ 37.10. Понятие о ядерных силах. § 37.11. Дефект массы атомных ядер. Энергия связи. Глава 38. КОСМИЧЕСКИЕ ЛУЧИ. ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ § 38.2. Открытие позитрона. § 38.3. Нейтрино. § 38.4. Открытие новых элементарных частиц. § 38.5. Классификация элементарных частиц. § 38.6. Античастицы. Взаимные превращения вещества и поля. § 38.7. Гипотеза кварков. Глава 39. АТОМНАЯ ЭНЕРГИЯ И ЕЕ ИСПОЛЬЗОВАНИЕ § 39.2. Деление тяжелых атомных ядер. § 39.3. Цепная реакция деления. Ядерный взрыв. § 39.4. Ядерный реактор. § 39.5. Развитие ядерной энергетики в СССР. § 39.6. Понятие о термоядерной реакции. Энергия Солнца и звезд. § 39.7. Понятие об управляемой термоядерной реакции. § 39.8. Получение радиоактивных изотопов и их применение. Раздел VI. ОСНОВНЫЕ СВЕДЕНИЯ ПО АСТРОНОМИИ Глава 40. СТРОЕНИЕ И РАЗВИТИЕ ВСЕЛЕННОЙ § 40.2. Происхождение и развитие небесных тел. § 40.3. Понятие о космологии. |
Связь между давлением и температурой
24 апреля 2018 г.
от Lakna
Чтение через 4 мин.
Связь между давлением и температурой газа определяется законом Гей-Люссака о давлении и температуре. Этот закон гласит, что давление (P) фиксированной массы газа при постоянном объеме прямо пропорционально его температуре по Кельвину (T). Следовательно, когда давление в конкретной системе повышается, температура этой системы также повышается, и наоборот. Газовые законы описывают поведение газов в зависимости от давления, объема, температуры и количества. Газы — одно из состояний вещества, либо очень сильно сжатое, либо расширенное, чтобы заполнить большое пространство.
Ключевые области, покрываемые
1. Каково давление
— Определение, давление газа
2. Какова температура
— Определение, измерение
. Температура
– Закон Гей-Люссака
Ключевые термины: газ, закон Гей-Люссака, Кельвин, давление, температура
в контакте с ним.
 Он рассчитывается как сила, приходящаяся на единицу площади. Когда рассматривается закрытая газовая камера, окруженная вакуумом, давление, оказываемое газом на стенки камеры, зависит от трех факторов. Это количество газа в камере, объем камеры и температура газа. Когда другие параметры постоянны, давление внутри камеры прямо пропорционально количеству газа в камере; обратно пропорциональна объему камеры; она прямо пропорциональна температуре газа внутри камеры. Давление определяется в Рисунок 1.
Он рассчитывается как сила, приходящаяся на единицу площади. Когда рассматривается закрытая газовая камера, окруженная вакуумом, давление, оказываемое газом на стенки камеры, зависит от трех факторов. Это количество газа в камере, объем камеры и температура газа. Когда другие параметры постоянны, давление внутри камеры прямо пропорционально количеству газа в камере; обратно пропорциональна объему камеры; она прямо пропорциональна температуре газа внутри камеры. Давление определяется в Рисунок 1. Рисунок 1: Давление
Атмосферное давление создается весом воздуха над нами. На уровне моря это 10 5 Па.
Что такое температура
Температура – это степень нагревания вещества или объекта. Он представляет собой внутреннюю энергию, содержащуюся в конкретной системе. Температуру можно измерить термометром, который откалиброван в различных единицах измерения. Шкала Цельсия является наиболее широко используемой шкалой для измерения температуры, которая обозначается в °C. Единицей измерения температуры в Международной системе единиц (СИ) является кельвин (К). Термометр изображен на рисунок 2.
Единицей измерения температуры в Международной системе единиц (СИ) является кельвин (К). Термометр изображен на рисунок 2.
Рисунок 2: Термометр
При самой низкой теоретической температуре, равной абсолютному нулю, тепловое движение частиц в веществе минимально. Абсолютный ноль равен 0 К, а это -273,14 °С.
Какая связь между давлением и температурой
Связь между давлением и температурой описывается применительно к газам. Закон Гей-Люссака — это газовый закон, описывающий зависимость давления от температуры. В нем говорится, что при постоянном объеме давление данного количества определенного газа прямо пропорционально его температуре по Кельвину. Можно записать так:
- П ∝ Т или
- P/T = k, где k — константа, или
- P 1 /T 1 = P 2 /T 2
Рисунок 3: Зависимость между давлением и температурой
При повышении температуры в конкретной системе молекулы газа движутся быстрее, оказывая большее давление на стенки газового баллона. Это в плане увеличивает давление в системе. Если температура системы снижается, давление падает. Следовательно, при постоянном объеме давление конкретного газа прямо пропорционально температуре.
Это в плане увеличивает давление в системе. Если температура системы снижается, давление падает. Следовательно, при постоянном объеме давление конкретного газа прямо пропорционально температуре.
Заключение
Давление данного количества газа прямо пропорционально температуре данного объема. При повышении температуры в системе повышается и давление, и наоборот. Связь между давлением и температурой газа определяется законом Гей-Люссака.
Ссылка:
1. «9.2 Соотношение давления, объема, количества и температуры: закон идеального газа». Химия , Доступно здесь.
Изображение предоставлено:
1. «Площадь силы давления» Клауса-Дитера Келлера — собственная работа (CC BY-SA 3.0) через Commons Wikimedia
2. «1134182» (CC0) через Pixabay
Об авторе: Лакна
Лакна, выпускник факультета молекулярной биологии и биохимии, молекулярный биолог и проявляет большой интерес к открытиям, связанным с природой
Просмотреть все сообщения
Вам также могут понравиться эти
газовых законов
газовых законов Следующее содержание является содержанием лекции 18. В этой лекции мы рассмотрим газовые законы: Шарля, Бойля, Авагадро и Гей-Люссака, а также законы идеального и комбинированного газа.
В этой лекции мы рассмотрим газовые законы: Шарля, Бойля, Авагадро и Гей-Люссака, а также законы идеального и комбинированного газа.
Законы свойств газа
Существует 4 общих закона, связывающих между собой 4 основных характерных свойства газов. Каждый закон назван по имени его первооткрывателя. Хотя важно понимать отношения, охватываемые каждым законом, знание отправителя не так важно и станет излишним после введения комбинированного закона о газах. Так что сконцентрируйтесь на понимании взаимосвязей, а не на запоминании имен.
Закон Чарльза — дает связь между объемом и температурой , если давление и количество газа поддерживаются постоянными :
1) Если температура газа по Кельвину увеличивается, объем газа увеличивается. (P, n постоянная)
2) Если температура газа по Кельвину уменьшается, объем газа уменьшается. (P, n постоянная)
Это означает, что объем газа прямо пропорционален его температуре по Кельвину. Подумайте об этом так: если вы увеличиваете объем газа и должны поддерживать постоянное давление, единственный способ добиться этого — повысить температуру газа.
Подумайте об этом так: если вы увеличиваете объем газа и должны поддерживать постоянное давление, единственный способ добиться этого — повысить температуру газа.
Расчеты с использованием закона Чарльза включают изменение либо температуры (T 2 ), либо объема (V 2 ) от известного начального количества каждого из них (V 1 и T 1 ):
Закон Бойля — гласит, что объем данного количества газа при постоянной температуре изменяется обратно пропорционально приложенному давлению, когда температура и масса постоянны.
Уменьшение объема газа означает, что молекулы чаще ударяются о стенки, увеличивая давление, и наоборот, если объем увеличивается, расстояние, которое молекулы должны пройти, чтобы удариться о стенки, увеличивается, и они реже ударяются о стенки, тем самым уменьшая давление.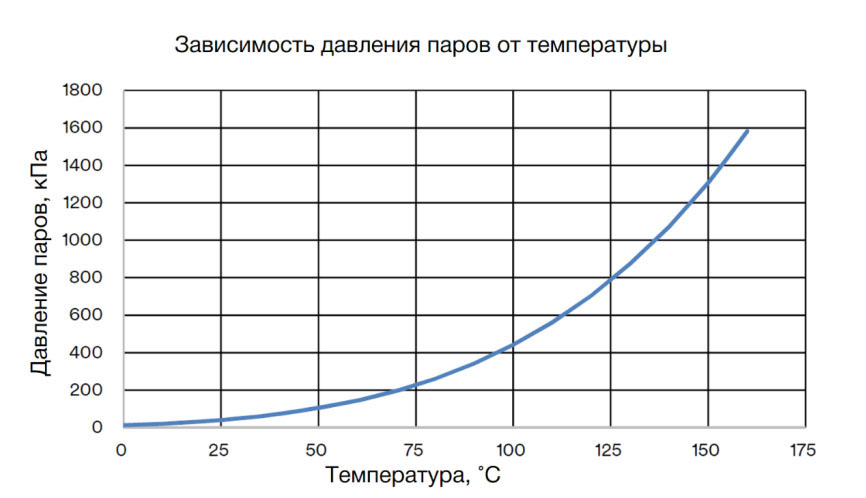 давление.
давление.
Как и закон Чарльза, закон Бойля можно использовать для определения текущего давления или объема газа, если известны начальные состояния и одно из изменений:
Закон Авагадро- Определяет соотношение между объемом и количеством газа в молях, когда давление и температура поддерживаются постоянными.
Если количество газа в контейнере увеличивается, объем увеличивается. Если количество газа в сосуде уменьшается, объем уменьшается. Это предполагает, конечно, что контейнер имеет расширяемые стенки.
Отношения снова прямо пропорциональны, поэтому уравнение для расчетов
Закон Гей-Люссака гласит, что давление данного количества газа при постоянном объеме прямо пропорционально температуре Кельвина.
Если вы нагреваете газ, вы даете молекулам больше энергии, чтобы они двигались быстрее.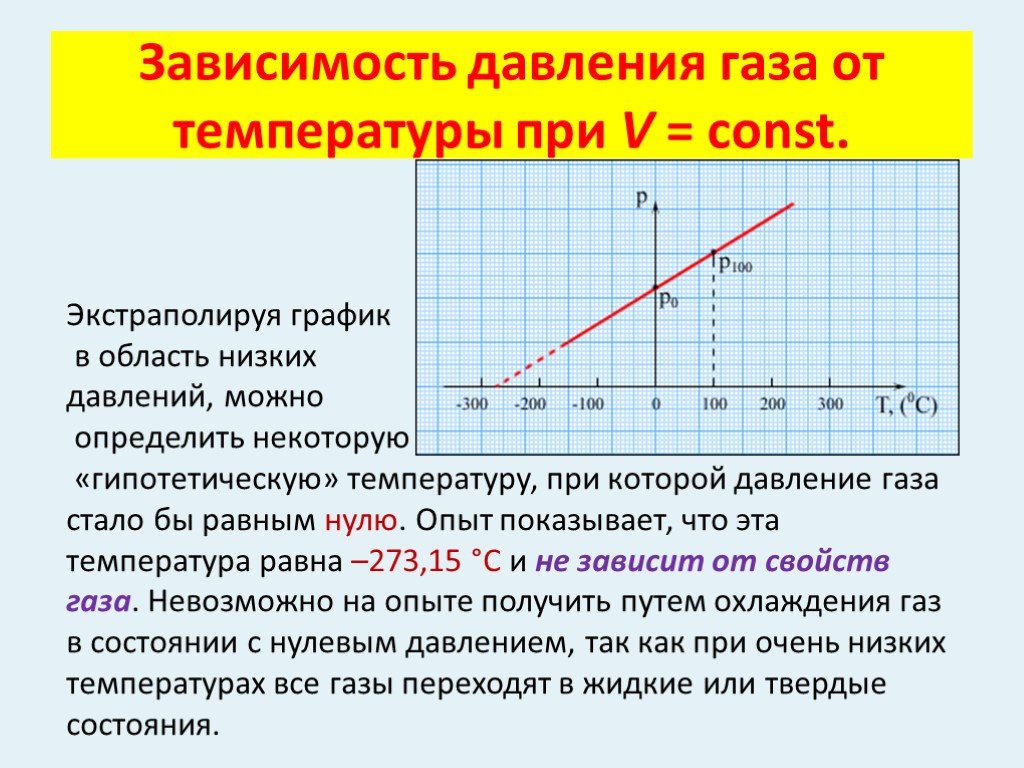 Это означает большее количество ударов о стенки контейнера и увеличение давления. И наоборот, если вы охладите молекулы, они замедлятся, и давление уменьшится.
Это означает большее количество ударов о стенки контейнера и увеличение давления. И наоборот, если вы охладите молекулы, они замедлятся, и давление уменьшится.
Чтобы рассчитать изменение давления или температуры с помощью закона Гей-Люссака, уравнение выглядит следующим образом:
Чтобы немного поиграть с отношениями, попробуйте эту симуляцию.
Закон идеального газа:
Комбинация представленных выше законов порождает закон идеального газа:
Добавление константы пропорциональности, называемой идеальной или универсальной газовой постоянной (R), завершает уравнение.
Как видите, существует множество возможных единиц измерения константы. Единственная постоянная константа заключается в том, что температурная шкала во всем — КЕЛЬВИН.
При использовании закона идеального газа для расчета любого свойства газа вы должны сопоставить единицы измерения с газовой постоянной, которую вы решили использовать, и вы всегда должны указывать свою температуру в градусах Кельвина.
Чтобы использовать уравнение, вам просто нужно определить, чего не хватает в вопросе, и перестроить уравнение, чтобы решить его.
Типичный вопрос был бы задан, поскольку 6,2 литра идеального газа содержатся при 3,0 атм и 37 °C. Сколько из этих молей газа присутствует?
Поскольку единицы газовой постоянной задаются с использованием атмосфер, молей и градусов Кельвина, важно убедиться, что вы конвертируете значения, указанные в других шкалах температуры или давления. Для этой задачи переведите температуру в градусах Цельсия в К, используя уравнение:
.Т = °С + 273
Т = 37 °С + 273
Т = 310 К
Теперь вы можете подставить значения. Решите для количества родинок
н = ПВ/РТ
n = (3,0 атм x 6,2 л) / (0,08206 л атм/моль К x 310 К)
n = 0,75 моль
Вот несколько практических задач на использование закона идеального газа: Практика
Закон о комбинированном газе
Выше я сказал, что запоминание всех уравнений для каждого из отдельных газовых законов станет неактуальным после введения последующих законов.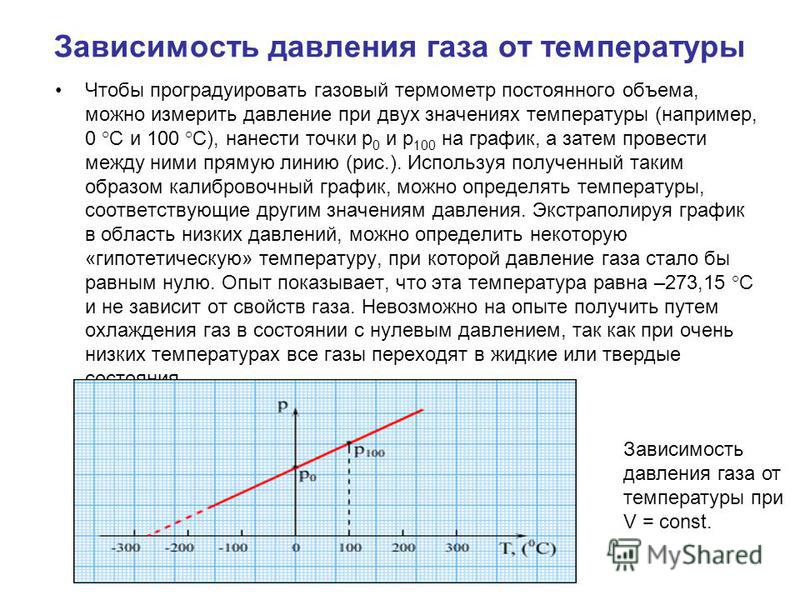 Закон, о котором я говорил, — это Закон о комбинированном газе:
Закон, о котором я говорил, — это Закон о комбинированном газе:
Комбинированный газовый закон позволяет вам получить любое из необходимых соотношений, комбинируя все изменяемые части в законе об идеальном газе: а именно: давление, температуру и объем. R и количество молей не появляются в уравнении, поскольку они обычно постоянны и, следовательно, сокращаются, поскольку они появляются в равных количествах в обеих частях уравнения.
Как видно выше, уравнение можно решить для любого из входящих в него параметров. Но что еще более важно, вы можете исключить из уравнения все, что останется постоянным.
Например, если в вопросе говорилось, что система при 1 атм и объеме 2 литра претерпела изменение на 3,5 литра, рассчитайте новое давление, вы можете просто исключить температуру из уравнения и получить:
P 2 = P 1 V 1 /V 2 = (1 атм)(2 л)/3,5 л) = 0,6 атм
Поскольку в вопросе никогда не упоминается температура, мы можем предположить, что она остается постоянной и, следовательно, не учитывается в расчетах.

 6)
6) 8)
8) —М.: Наука. Главная редакция физико-математической литературы, 1984. — 512 с.
—М.: Наука. Главная редакция физико-математической литературы, 1984. — 512 с.