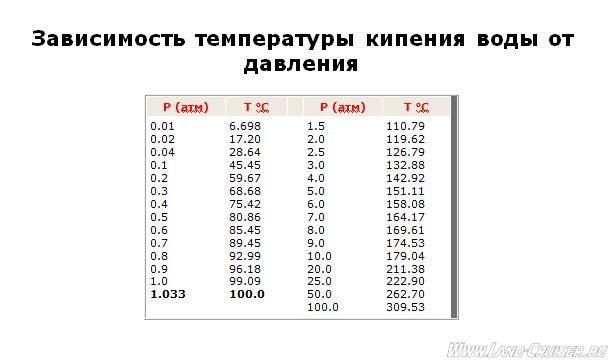
Зависимость температуры кипения воды от высоты над уровнем моря
РаботаИнженерные
Калькулятор рассчитывает температуру кипения воды в зависимости от температуры воздуха и высоты над уровнем моря
После создания пары калькуляторов на тему давления вообще (Конвертер единиц давления) и атмосферного давления в частности (Барометрическое нивелирование), захотелось узнать, как рассчитать температуру кипения воды в зависимости от высоты. Я откуда-то знал, что на высоте вода кипит при температуре ниже 100°С — а вот при какой точно температуре она кипит — вопрос.
Задача состоит из двух этапов — установить зависимость атмосферного давления от высоты и зависимость температуры кипения от давления. Начнем с последнего, как с более интересного.
Кипение представляет собой фазовый переход первого рода (вода сменяет агрегатное состояние из жидкого на газообразное).
Фазовый переход первого рода описывается уравнением Клапейрона:
,
где
— удельная теплота фазового перехода, которая численно равна количеству теплоты сообщаемой единице массы вещества для осуществления фазового перехода,
— изменение удельного объема при переходе
Клаузиус упростил уравнение Клапейрона для случаев испарения и возгонки, предположив, что
- Пар подчиняется закону идеального газа
- Удельный объем жидкости много меньше удельного объема пара
Из пункта один следует, что состояние пара можно описать уравнением Менделеева-Клапейрона
,
а из пункта два — что удельным объемом жидкости можно пренебречь.
Таким образом, уравнение Клапейрона принимает вид
,
где удельный объем можно выразить через
,
и окончательно
разделяя переменные, получим
Проинтегрировав левую часть от до , а правую от до , т.е. от одной точки до другой точки , лежащей на линии равновесия жидкость-пар, получим уравнение
называемое уравнением Клаузиуса-Клапейрона.
Собственно, это и есть искомая зависимость температуры кипения от давления.
Проведем еще пару преобразований
,
здесь
— молярная масса воды, 18 г/моль
— универсальная газовая постоянная, 8.31 Дж/(моль × К)
— удельная теплота испарения воды 2.3 × 106 Дж/кг
Теперь осталось установить зависимость атмосферного давления от высоты. Здесь мы воспользуемся барометрической формулой (другой у нас все равно нет):
или
,
здесь
— молярная масса воздуха, 29 г/моль
— универсальная газовая постоянная, 8.31 Дж/(моль×К)
— ускорение силы тяжести, 9. 81 м/(с×с)
81 м/(с×с)
— температура воздуха
Значения, относящиеся к воздуху, пометим индексом v, к воде — h
Приравняв и избавившись от экспоненты, получим
Ну и итоговая формула
На самом деле реальное давление воздуха не следует барометрической формуле, так как при больших перепадах высот температуру воздуха нельзя считать постоянной. Кроме того, ускорение свободного падения зависит от географической широты, а атмосферное давление — еще и от концентрации паров воды. То есть значение по этой формуле мы получим приближенное. Поэтому ниже я включил еще один калькулятор, который использует использует формулу для расчет температуры кипения в зависимости от давления воздуха в миллиметрах ртутного столба.
Калькулятор зависимости температуры кипения от высоты:
Зависимость температуры кипения воды от высоты над уровнем моря
Высота
Высота (метры)
Температура
Температура воздуха (Цельсий)
Точность вычисления
Знаков после запятой: 1
Температура кипения
Калькулятор зависимости температуры кипения от давления:
Зависимость температуры кипения воды от давления
Давление воздуха, мм.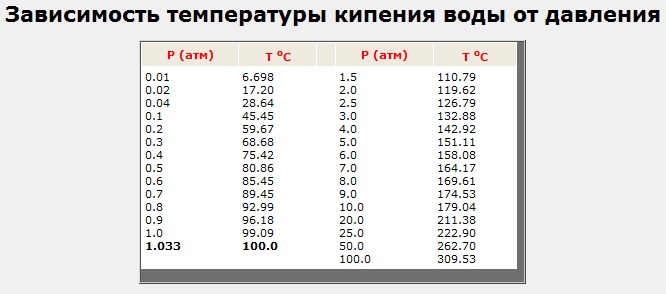 рт.ст.
рт.ст.
Точность вычисления
Знаков после запятой: 1
Температура кипения
Ссылка скопирована в буфер обмена
Похожие калькуляторы
- • Зависимость давления от высоты над уровнем моря
- • Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
- • Метод итераций (метод последовательных приближений)
- • Барометрическое нивелирование
- • Абсолютная влажность воздуха и относительная влажность воздуха
- • Раздел: Инженерные ( 101 калькуляторов )
высота высота над уровнем моря давление Инженерные кипение температура температура кипения Термодинамика уравнение Клаузиуса-Клапейрона уравнение Менделеева-Клапейрона Физика
PLANETCALC, Зависимость температуры кипения воды от высоты над уровнем моря
Timur2020-11-03 14:19:27
как отличается и от чего зависит
Опубликовано:
Известно, что вода кипит при 100 °С.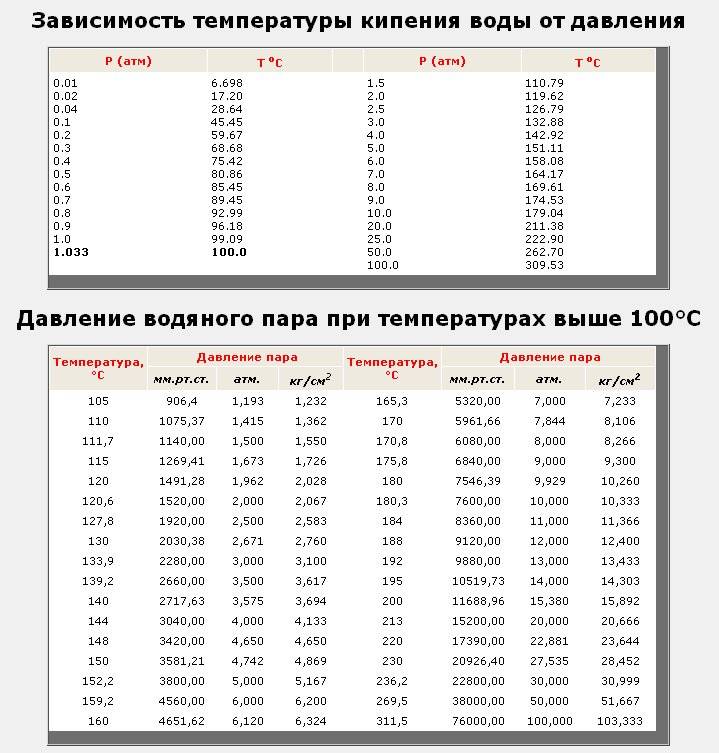 Однако практика показывает, что вода может закипеть и при комнатной температуре, и при 130 °С. В каких условиях это бывает, поведали экспериментаторы.
Однако практика показывает, что вода может закипеть и при комнатной температуре, и при 130 °С. В каких условиях это бывает, поведали экспериментаторы.
Что такое кипение воды и что на него влияет
В науке кипение определяется как смена агрегатного состояния вещества при нагревании, переход из жидкого состояния в парообразное, то есть с выделением пара. При какой температуре закипает вода? Физика утверждает, что чистая пресная вода при нормальном давлении в 1 атмосферу (760 мм ртутного столба) кипит при 100 °С. Но технические справочники, а также экспериментаторы Яков Перельман, Илья Мельников доказывают, что эти параметры могут быть другими при определенных условиях.
Процесс кипения воды в быту видим ежедневно. При внимательном наблюдении можем выделить такие стадии кипения:
- Через несколько мгновений после того как поставили чайник на огонь, видим образование в нем небольших пузырьков на дне и стенках. Это от нагревания из микротрещин посуды выделяется нагретый воздух.

- Далее пузырьки расширяются и стремятся вверх. Увеличиваются они уже за счет пара, в который превращается вода при нагревании. Поднимаются, потому что плотность пара меньше, чем воды. При этом холодные верхние слои воды опускаются вниз, сталкиваются с пузырями. Так возникают звуковые волны — характерные звуки чайника при закипании.
- Пузырьков становится все больше, появляется эффект мутной воды, известный как белое кипение.
- Наконец начинается интенсивное бурление воды: пузыри лопаются, появляется обильный пар и брызги. Вода кипит.
Какая температура кипения воды в чайнике? В чайник заливаем чистую воду, без солей и иных добавок. Кипятим ее при нормальных условиях, то есть при атмосферном давлении на поверхности Земли в одну атмосферу. По закону физики следует, что вода закипела при температуре 100 °С.
После того как вода закипела, ее температура остается постоянной. При достижении температуры кипения все дополнительное количество теплоты идет на образование пара, вода просто испаряется. Авторы книги «Физика для всех» объясняют процесс испарения так: пар над водой перемешивается с более холодными высокими слоями воздуха без пара. Это будет продолжаться непрерывно, пока вся вода не испарится.
Авторы книги «Физика для всех» объясняют процесс испарения так: пар над водой перемешивается с более холодными высокими слоями воздуха без пара. Это будет продолжаться непрерывно, пока вся вода не испарится.
На практике воду приходится кипятить не только в обычных условиях. Например, туристы в горах знают, что вода закипает при температуре ниже 100 °С, что мешает заварить крепкий чай и приготовить горячую пищу.
Опытным путем выявлено, что при более высоком давлении, превышающем 1 атмосферу, температура кипения воды значительно повышается. При низком давлении, например, при создании вакуума, наблюдается обратный процесс: вода может закипеть при температуре значительно ниже 100 °С.
Замечено также, что на температуру кипения воды влияет ее состав. Так, соленая вода требует большего нагревания для кипения.
От чего зависит температура кипения? Практика и научные эксперименты доказывают, что температура кипения воды зависит от условий — нормального, повышенного или пониженного атмосферного давления, а также от наличия в жидкости посторонних примесей, солей и добавок.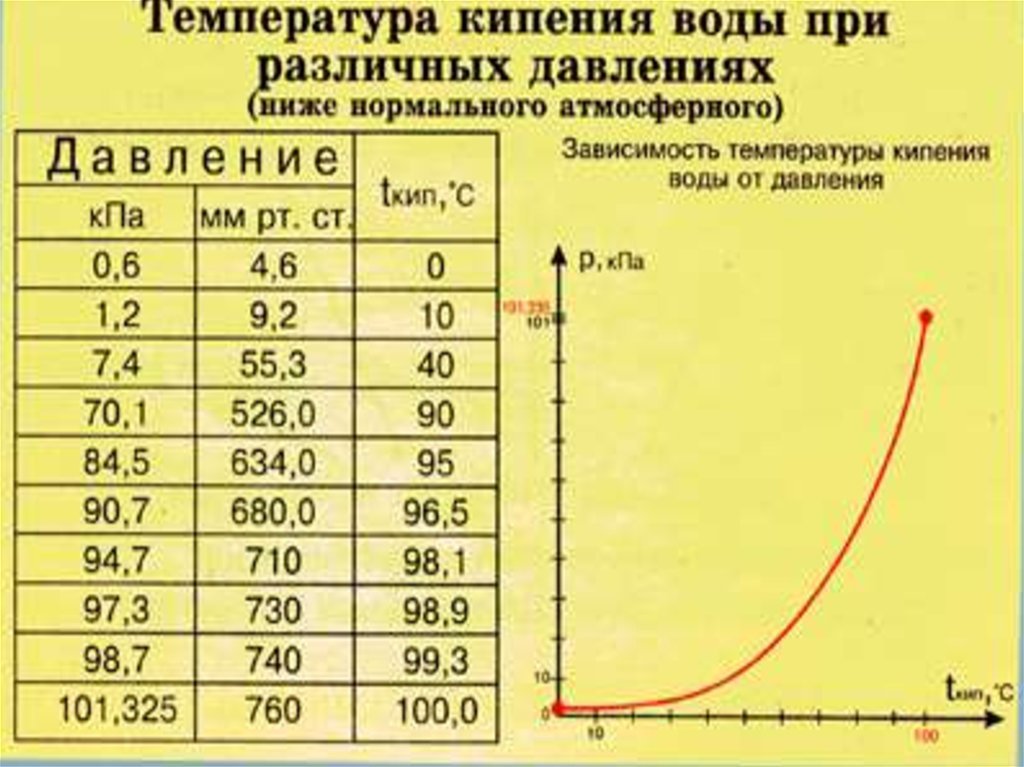
Как влияют условия и состав воды на температуру кипения
Какая температура кипения воды в горах? При подъеме в горы воздух становится более разреженным: при увеличении высоты над уровнем моря атмосферное давление понижается. Наблюдается такая закономерность: при подъеме на каждые 300 м температура кипения воды понижается примерно на 1 °С, на высоте 1 000 м она составит около 96,3 °С (погрешности обусловлены составом воды).
В горах Казахстана температура закипания воды будет такой:
- На пике Хан-Тенгри (7010 м) — около 77,2 °С.
- На пике Талгар (4979 м) — 83,5 °С.
- На Актау (4690 м) — 84,4 °С.
- На Белухе (4506 м) — 84,9 °С.
Автор книги «Занимательная физика» Яков Перельман утверждает, что правильным будет обратный расчет, если помнить, что температура кипения воды падает на 3 °С с каждым километром высоты. Тогда по температуре кипения воды можно определить, на какой высоте в горах находятся туристы.
Опытным путем можно определить, как меняется температура кипения при дальнейшем понижении атмосферного давления, например, при создании вакуума (откачивая воздух из какой-то емкости, куда помещен сосуд с водой). При давлении в 0,5 атмосфер вода закипит при температуре 80,8 °С, а при давлении в 0,03 атмосфер можно наблюдать прохладный кипяток — кипение воды комнатной температуры 17,2 °С. Этот эффект нашел практическое применение в технологии вакуумной сушки, когда добиваются испарения влаги при невысокой температуре.
При повышении атмосферного давления вода закипает при более высоких температурах, чем 100 °С. Яков Перельман приводит пример, что в шахте, где давление выше, чем на поверхности, получают кипяток горячее — 101 °С на глубине 300 м, на глубине 600 м — 102 °С.
При давлении 1,5 атмосферы температура кипения будет 110,8 °С, при 2 — 120 °С, при 3 — 132,8 °С. Такой эффект применяется в жизни для более быстрого приготовления блюд в скороварках, где создается давление в 2–3 атмосферы.
Зависит температура кипения воды от ее состава. В воде с добавлением соли ее молекулы Na+ и Cl- заполняют часть пространства между молекулами воды. При этом нарушается связь между ними, что препятствует нагреванию воды. Поэтому для кипения соленой воды требуется более высокая температура. Так, если в 1 л воды добавить 60 г соли, то температура кипения увеличится на 10 °С.
Автор книги «Невероятные физические опыты» Илья Мельников приводит опытное доказательство такого факта. Если в кастрюле с чистой кипящей водой держать на пару бутылочку с водой, то вода в бутылочке не закипит, стекло при такой температуре препятствует кипению. Но если в воду в кастрюле добавить соль, то температура кипения повысится, что доведет к кипению воды в бутылочке.
Такие вот метаморфозы происходят с водой. В обычных условиях температура ее кипения может быть эталоном, но измените условия, и она будет или прохладным, или очень горячим кипятком.
Оригинал статьи: https://www.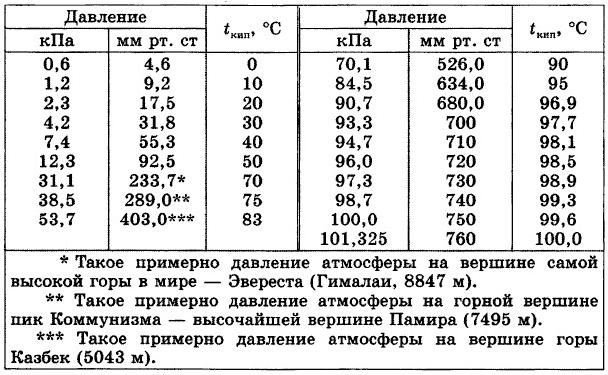 nur.kz/family/school/1750018-pri-kakoj-temperature-kipit-voda-vysoko-v-gorah/
nur.kz/family/school/1750018-pri-kakoj-temperature-kipit-voda-vysoko-v-gorah/
5.5: Давление паров — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 36159
Точки кипения
По мере повышения температуры жидкости давление паров жидкости увеличивается до тех пор, пока не сравняется с внешним давлением или атмосферным давлением в случае открытого контейнера. В жидкости начинают образовываться пузырьки пара, и жидкость начинает кипеть.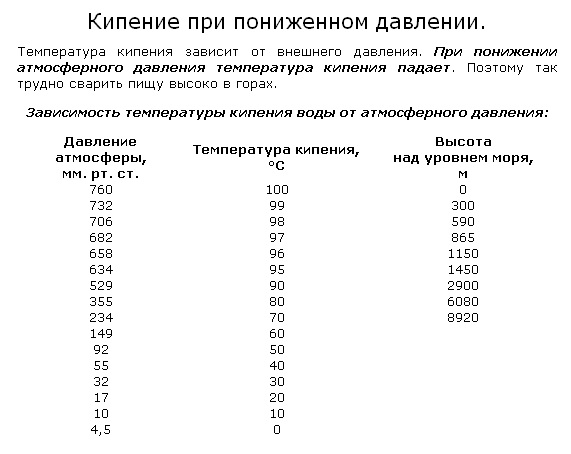 Температура, при которой жидкость кипит при давлении ровно 1 атм, является нормальной точкой кипения жидкости. Для воды нормальная температура кипения составляет ровно 100°С. Нормальные температуры кипения других жидкостей на рис. 5.5.4 представлены точками, в которых кривые давления пара пересекают линию, соответствующую давлению 1 атм. Хотя мы обычно ссылаемся на нормальную температуру кипения жидкости,
Температура, при которой жидкость кипит при давлении ровно 1 атм, является нормальной точкой кипения жидкости. Для воды нормальная температура кипения составляет ровно 100°С. Нормальные температуры кипения других жидкостей на рис. 5.5.4 представлены точками, в которых кривые давления пара пересекают линию, соответствующую давлению 1 атм. Хотя мы обычно ссылаемся на нормальную температуру кипения жидкости,
| Место | Высота над уровнем моря (футы) | Атмосферное давление (мм рт.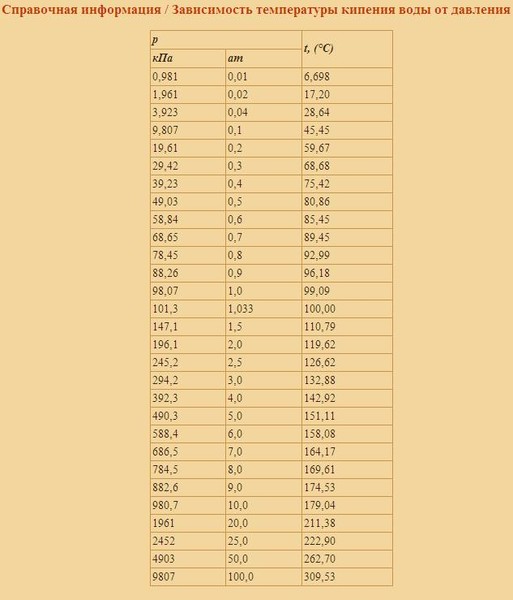 ст.) ст.) | Температура кипения воды (°C) |
|---|---|---|---|
| Эверест, Непал/Тибет | 29 028 | 240 | 70 |
| Богота, Колумбия | 11 490 | 495 | 88 |
| Денвер, Колорадо | 5280 | 633 | 95 |
| Вашингтон, округ Колумбия | 25 | 100 | |
| Мертвое море, Израиль/Иордания | −1312 | 799 | 101,4 |
Типичные колебания атмосферного давления на уровне моря относительно малы и вызывают лишь незначительные изменения температуры кипения воды. Например, самое высокое зарегистрированное атмосферное давление на уровне моря составляет 813 мм рт.ст., зарегистрированное в сибирскую зиму; самое низкое давление на уровне моря, когда-либо измеренное, составляло 658 мм рт.ст. во время тихоокеанского тайфуна. При этих давлениях температура кипения воды изменяется минимально, до 102°С и 96°С соответственно. На больших высотах, напротив, становится существенной зависимость температуры кипения воды от давления. В таблице 5.5.1 перечислены точки кипения воды в нескольких местах на разных высотах. Например, на высоте всего 5000 футов температура кипения воды уже ниже самой низкой из когда-либо зарегистрированных на уровне моря. Более низкая температура кипения воды имеет серьезные последствия для приготовления всего: от яиц всмятку («трехминутное яйцо» вполне может занять четыре или более минут в Скалистых горах и даже дольше в Гималаях) до тортов (смеси для тортов часто продаются с отдельными высотными инструкциями). И наоборот, скороварки, которые имеют уплотнение, позволяющее давлению внутри них превышать 1 атм, используются для более быстрого приготовления пищи за счет повышения точки кипения воды и, следовательно, температуры, при которой готовится пища.
Например, самое высокое зарегистрированное атмосферное давление на уровне моря составляет 813 мм рт.ст., зарегистрированное в сибирскую зиму; самое низкое давление на уровне моря, когда-либо измеренное, составляло 658 мм рт.ст. во время тихоокеанского тайфуна. При этих давлениях температура кипения воды изменяется минимально, до 102°С и 96°С соответственно. На больших высотах, напротив, становится существенной зависимость температуры кипения воды от давления. В таблице 5.5.1 перечислены точки кипения воды в нескольких местах на разных высотах. Например, на высоте всего 5000 футов температура кипения воды уже ниже самой низкой из когда-либо зарегистрированных на уровне моря. Более низкая температура кипения воды имеет серьезные последствия для приготовления всего: от яиц всмятку («трехминутное яйцо» вполне может занять четыре или более минут в Скалистых горах и даже дольше в Гималаях) до тортов (смеси для тортов часто продаются с отдельными высотными инструкциями). И наоборот, скороварки, которые имеют уплотнение, позволяющее давлению внутри них превышать 1 атм, используются для более быстрого приготовления пищи за счет повышения точки кипения воды и, следовательно, температуры, при которой готовится пища.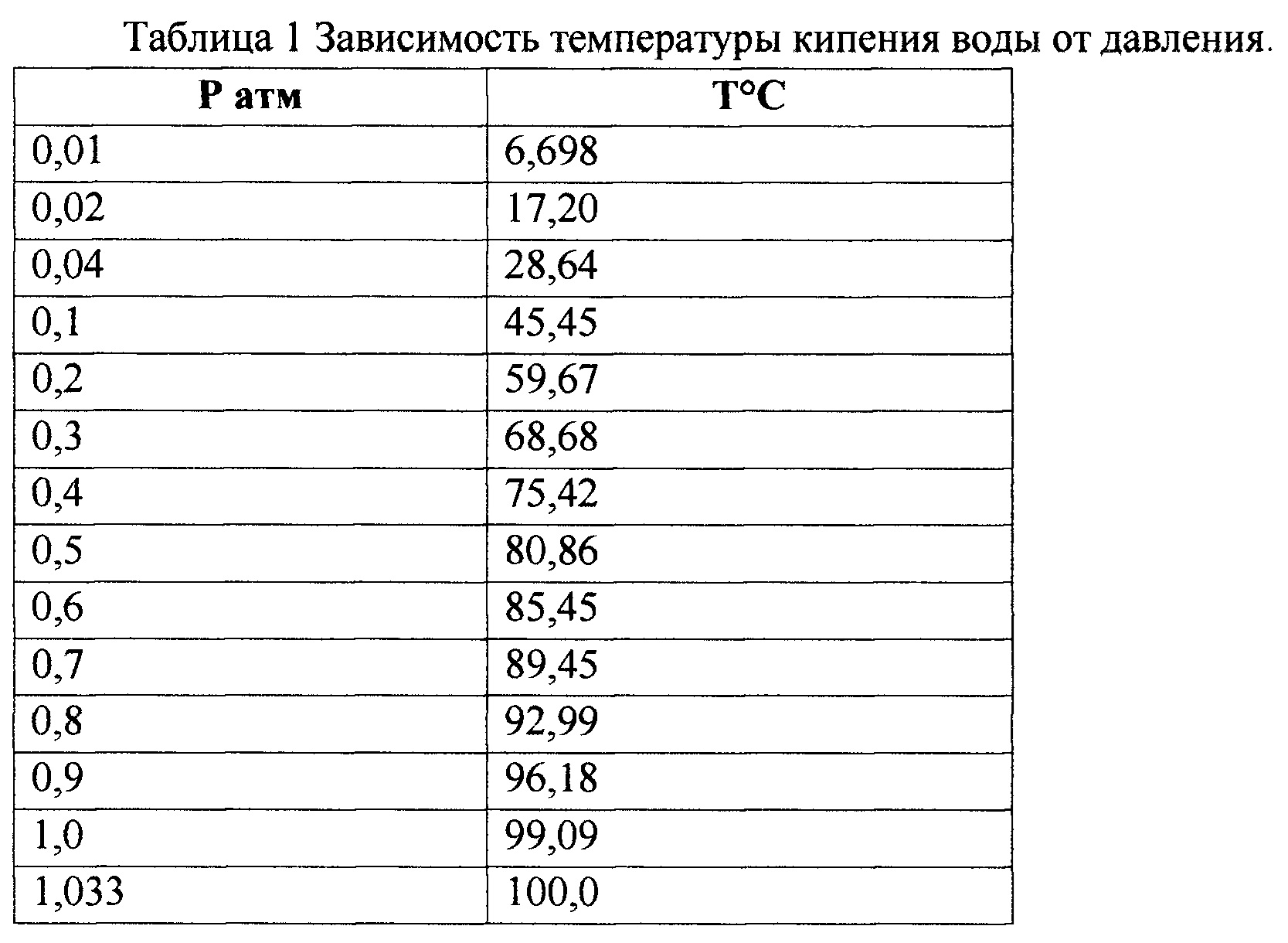
Примечание
При увеличении давления температура кипения жидкости увеличивается и наоборот.
Пример 5.5.2: Кипящая ртуть
Используйте рис. 5.5.4 для оценки следующего.
- температура кипения воды в скороварке при давлении 1000 мм рт.ст.
- давление, при котором ртуть закипает при температуре 250°C
Ртуть кипит при 356 °C при комнатном давлении. Для просмотра видео перейдите по ссылке https://www.youtube.com/watch?v=0iizsbXWYoo
Дано: данные на рис. 5.5.4, давление и температура кипения
Запрошено: соответствующая температура кипения и давление
Стратегия:
- Для оценки температуры кипения воды при 1000 мм рт.ст., обратитесь к рисунку 5.5.4 и найдите точку пересечения кривой давления пара воды с линией, соответствующей давлению 1000 мм рт.ст.
- Чтобы оценить давление, необходимое для кипения ртути при температуре 250°С, найдите точку, в которой кривая давления паров ртути пересекает линию, соответствующую температуре 250°С.

Решение:
- A Кривая давления пара воды пересекает линию P = 1000 мм рт.ст. при температуре около 110°C; следовательно, это точка кипения воды при 1000 мм рт.
- B Вертикальная линия, соответствующая 250°C, пересекает кривую давления паров ртути в точке P ≈ 75 мм рт.ст. Следовательно, это давление, необходимое для того, чтобы ртуть закипела при температуре 250°C.
Упражнение 5.5.2. Кипячение этиленгликоля
Этиленгликоль представляет собой органическое соединение, в основном используемое в качестве сырья при производстве полиэфирных волокон и тканей, а также полиэтилентерефталатных смол (ПЭТ), используемых при розливе. Используйте данные на рис. 5.5.4, чтобы оценить следующее.
- нормальная температура кипения этиленгликоля
- давление, необходимое для кипения диэтилового эфира при температуре 20°С.
- Ответ (а):
- 200°С
- Ответ (б):
- 450 мм рт.
 ст.
ст.
Резюме
Поскольку молекулы жидкости находятся в постоянном движении и обладают широким диапазоном кинетических энергий, в любой момент некоторая их часть имеет достаточную энергию, чтобы покинуть поверхность жидкости и перейти в газовую или паровую фазу. Этот процесс, называемый испарением или испарением , создает давление пара над жидкостью. Молекулы в газовой фазе могут столкнуться с поверхностью жидкости и снова войти в жидкость через конденсат . В конце концов, достигается стационарное состояние , в котором количество молекул, испаряющихся и конденсирующихся в единицу времени, одинаково, и система находится в состоянии динамического равновесия . В этих условиях жидкость проявляет характерное равновесное давление пара , которое зависит только от температуры. Мы можем выразить нелинейную зависимость между давлением паров и температурой как линейную зависимость, используя уравнение Клаузиуса-Клапейрона . Это уравнение можно использовать для расчета энтальпии испарения жидкости по измеренному давлению пара при двух или более температурах. Летучие жидкости – жидкости с высоким давлением паров, которые легко испаряются из открытого контейнера; нелетучие жидкости имеют низкое давление паров. Когда давление пара становится равным внешнему давлению, внутри жидкости образуются пузырьки пара, и она закипает. Температура кипения вещества при давлении 1 атм равна его нормальная температура кипения .
Это уравнение можно использовать для расчета энтальпии испарения жидкости по измеренному давлению пара при двух или более температурах. Летучие жидкости – жидкости с высоким давлением паров, которые легко испаряются из открытого контейнера; нелетучие жидкости имеют низкое давление паров. Когда давление пара становится равным внешнему давлению, внутри жидкости образуются пузырьки пара, и она закипает. Температура кипения вещества при давлении 1 атм равна его нормальная температура кипения .
Авторы и авторство
Изменено Джошуа Халперном (Университет Говарда)
5.5: Vapor Pressure распространяется под лицензией CC BY-NC-SA 4.0, автор, ремикс и/или куратор LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
Как определить температуру кипения с помощью давления
Обновлено 14 декабря 2020 г.
Автор: Карен Г. Блаттлер быстрее, чем ожидалось. Будь то кемпинг или химия, предсказать температуру кипения может быть непросто.
TL;DR (слишком длинное; не читал)
Определение точки кипения на основе давления можно выполнить с помощью уравнений, оценок, номограмм, онлайн-калькуляторов, таблиц и графиков.
Понятие о температуре кипения
Кипение происходит, когда давление паров жидкости равняется давлению воздуха над жидкостью. Например, на уровне моря вода кипит при температуре 212°F (100°C). По мере увеличения высоты количество атмосферы над жидкостью уменьшается, поэтому температура кипения жидкости снижается. В общем, чем ниже атмосферное давление, тем ниже температура кипения любой жидкости. Помимо атмосферного давления на температуру кипения влияет молекулярная структура и притяжение между молекулами жидкости. Жидкости со слабыми межмолекулярными связями кипят, как правило, при более низких температурах, чем жидкости с сильными межмолекулярными связями. 9oC)+32
В общем, чем ниже атмосферное давление, тем ниже температура кипения любой жидкости. Помимо атмосферного давления на температуру кипения влияет молекулярная структура и притяжение между молекулами жидкости. Жидкости со слабыми межмолекулярными связями кипят, как правило, при более низких температурах, чем жидкости с сильными межмолекулярными связями. 9oC)+32
, где T означает температуру. Что касается атмосферного давления, единицы измерения давления компенсируются, поэтому единицы измерения, будь то миллиметры ртутного столба, бары, фунты на квадратный дюйм или другие, менее важны, чем уверенность в том, что все измерения давления являются одними и теми же единицами.
Одна из формул для расчета точки кипения воды использует известную точку кипения на уровне моря, 100°C, атмосферное давление на уровне моря и атмосферное давление в то время и на высоте, где происходит кипение. 9o\text{C/мм рт.ст.}
можно использовать для нахождения неизвестной температуры кипения воды.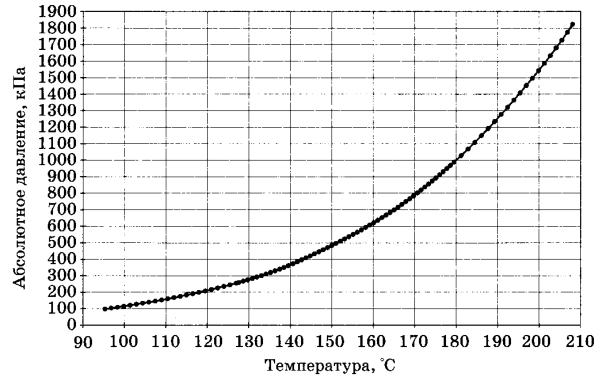
В этой формуле BPcorr означает температуру кипения на уровне моря, BPobs — неизвестную температуру, а Pobs — атмосферное давление в данном месте. Значение 760 мм рт. ст. представляет собой стандартное атмосферное давление в миллиметрах ртутного столба на уровне моря, а 0,045 o C/мм рт. ст. представляет собой приблизительное изменение температуры воды при изменении давления на каждый миллиметр ртутного столба.
Если атмосферное давление равно 600 мм ртутного столба и точка кипения при этом давлении неизвестна, то уравнение принимает вид
100°\text{C}=BP_{набл.}-(600\text{ мм рт.ст.}-760\text{ мм рт.ст.})\times 0,045°\text{C/мм рт.ст.}
Расчет уравнения дает:
100°\text{C}=BP_{набл.}-(-160\text{ мм рт.ст.})\times 0,045°\text{C/мм рт.ст.} = BP_{набл.}+7,2
Единицы мм рт.ст. компенсируют друг друга , оставив единицы измерения в градусах Цельсия. Решение для точки кипения при 600 мм рт. ст. дает следующее уравнение:
BP_{набл.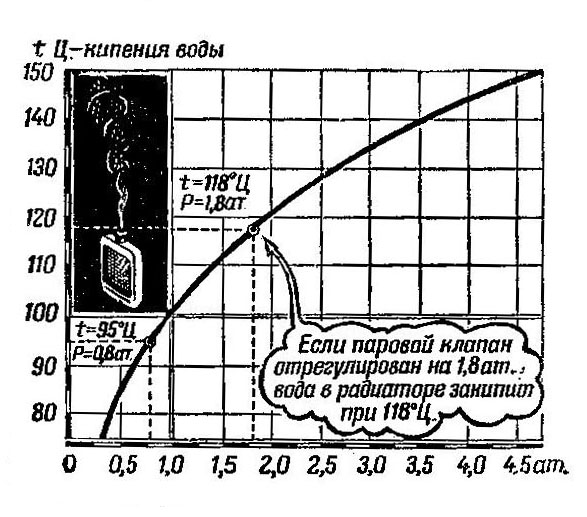 }=100°\text{C}-7,2°\text{C}=92,8°\text{C}
}=100°\text{C}-7,2°\text{C}=92,8°\text{C}
Итак, точка кипения воды при 600 мм рт. ст., на высоте примерно 6400 футов над уровнем моря, будет 92,8°C, или:
92,8\times\frac{9}{5}+32=199°\text{F}
Предупреждения
На больших высотах более низкая температура кипения воды требует приготовления пищи для более длительное время для обеспечения адекватной внутренней температуры. В целях безопасности используйте термометр для мяса, чтобы проверить температуру.
Уравнения для расчета температуры кипения
В приведенном выше уравнении используется известное соотношение давления и температуры с известным изменением температуры при изменении давления. Другие методы расчета точек кипения жидкостей на основе атмосферного давления, такие как уравнение Клаузиуса-Клапейрона:
\ln{\frac{P_1}{P_2}}=-\frac{L}{R}\times (\frac{1}{T_1}-\frac{1}{T_2})
включают дополнительные коэффициенты .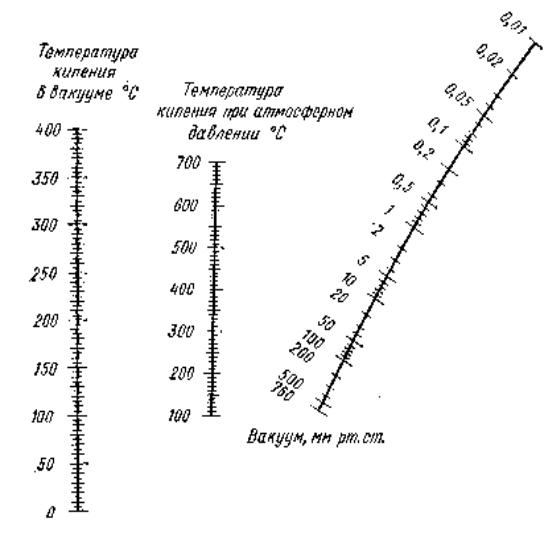 Например, в уравнении Клаузиуса-Клапейрона уравнение включает натуральный логарифм (ln) начального давления, деленный на конечное давление, скрытую теплоту (L) материала и универсальную газовую постоянную (R). Скрытая теплота связана с притяжением между молекулами, свойством материала, влияющим на скорость испарения. Материалы с более высокой скрытой теплотой требуют больше энергии для кипения, потому что молекулы имеют более сильное притяжение друг к другу.
Например, в уравнении Клаузиуса-Клапейрона уравнение включает натуральный логарифм (ln) начального давления, деленный на конечное давление, скрытую теплоту (L) материала и универсальную газовую постоянную (R). Скрытая теплота связана с притяжением между молекулами, свойством материала, влияющим на скорость испарения. Материалы с более высокой скрытой теплотой требуют больше энергии для кипения, потому что молекулы имеют более сильное притяжение друг к другу.
Оценка температуры кипения
В общем случае приблизительное падение температуры кипения воды можно сделать на основе высоты над уровнем моря. На каждые 500 футов увеличения высоты температура кипения воды падает примерно на 0,9°F.
Определение температуры кипения с помощью номограмм
Номограмму также можно использовать для оценки температуры кипения жидкостей. В номограммах для прогнозирования температуры кипения используются три шкалы. На номограмме показаны шкала температуры кипения, шкала температуры кипения на уровне моря и шкала общего давления.
На номограмме показаны шкала температуры кипения, шкала температуры кипения на уровне моря и шкала общего давления.
Чтобы использовать номограмму, соедините два известных значения с помощью линейки и прочтите неизвестное значение на третьей шкале. Начните с одного из известных значений. Например, если известна точка кипения на уровне моря и барометрическое давление, соедините эти две точки линейкой. Продление линии от двух соединенных известных показывает, какой должна быть температура точки кипения на этой высоте. И наоборот, если известна температура точки кипения и известна температура кипения на уровне моря, используйте линейку, чтобы соединить две точки, продолжая линию, чтобы найти барометрическое давление.
Использование онлайн-калькуляторов
Несколько онлайн-калькуляторов показывают температуру кипения на разных высотах. Многие из этих калькуляторов показывают только взаимосвязь между атмосферным давлением и точкой кипения воды, но другие показывают дополнительные общие соединения.
Использование графиков и таблиц
Разработаны графики и таблицы температур кипения многих жидкостей. В случае таблиц температура кипения жидкости указана для различных атмосферных давлений. В некоторых случаях в таблице указана только одна жидкость и температура кипения при различных давлениях. В других случаях могут быть показаны несколько жидкостей при разном давлении.
Графики показывают кривые температуры кипения в зависимости от температуры и барометрического давления. Графики, как и номограмма, используют известные значения для создания кривой или, как в уравнении Клаузиуса-Клапейрона, используют натуральный логарифм давления для построения прямой линии. Линия графика показывает известные зависимости температуры кипения при заданном наборе значений давления и температуры. Зная одно значение, следуйте по линии значения к линии давления-температуры на графике, затем поверните к другой оси, чтобы определить неизвестное значение.
