материалы для подготовки к ЕГЭ по Физике
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: изопроцессы — изотермический, изохорный, изобарный процессы.На протяжении этого листка мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что:
• , то есть нет утечки газа из сосуда или, наоборот, притока газа в сосуд;
• , то есть частицы газа не испытывают каких-либо изменений (скажем, отсутствует диссоциация — распад молекул на атомы).
Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения.
Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры.
Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
1. Изотермический процесс идёт при постоянной температуре газа: .
2. Изобарный процесс идёт при постоянном давлении газа: .
3. Изохорный процесс идёт при постоянном объёме газа: .
Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Шарля. Давайте перейдём к их изучению.
Изотермический процесс
Пусть идеальный газ совершает изотермический процесс при температуре .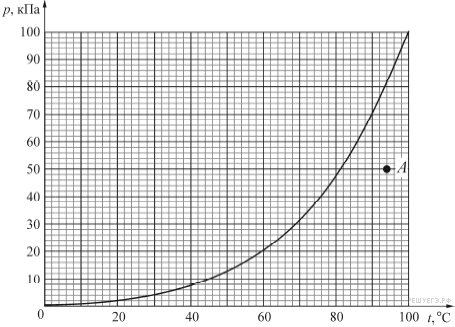 В ходе процесса меняются только давление газа и его объём.
В ходе процесса меняются только давление газа и его объём.
Рассмотрим два произвольных состояния газа: в одном из них значения макроскопических параметров равны , а во втором — . Эти значения связаны уравнением Менделеева-Клапейрона:
Как мы сказали с самого начала,масса и молярная масса предполагаются неизменными.
Поэтому правые части выписанных уравнений равны. Следовательно, равны и левые части:
(1)
Поскольку два состояния газа были выбраны произвольно, мы можем заключить, что в ходе изотермического процесса произведение давления газа на его объём остаётся постоянным:
(2)
Данное утверждение называется законом Бойля — Мариотта.
Записав закон Бойля — Мариотта в виде
(3)
можно дать и такую формулировку: в изотермическом процессе давление газа обратно пропорционально его объёму. Если, например, при изотермическом расширении газа его объём увеличивается в три раза, то давление газа при этом в три раза уменьшается.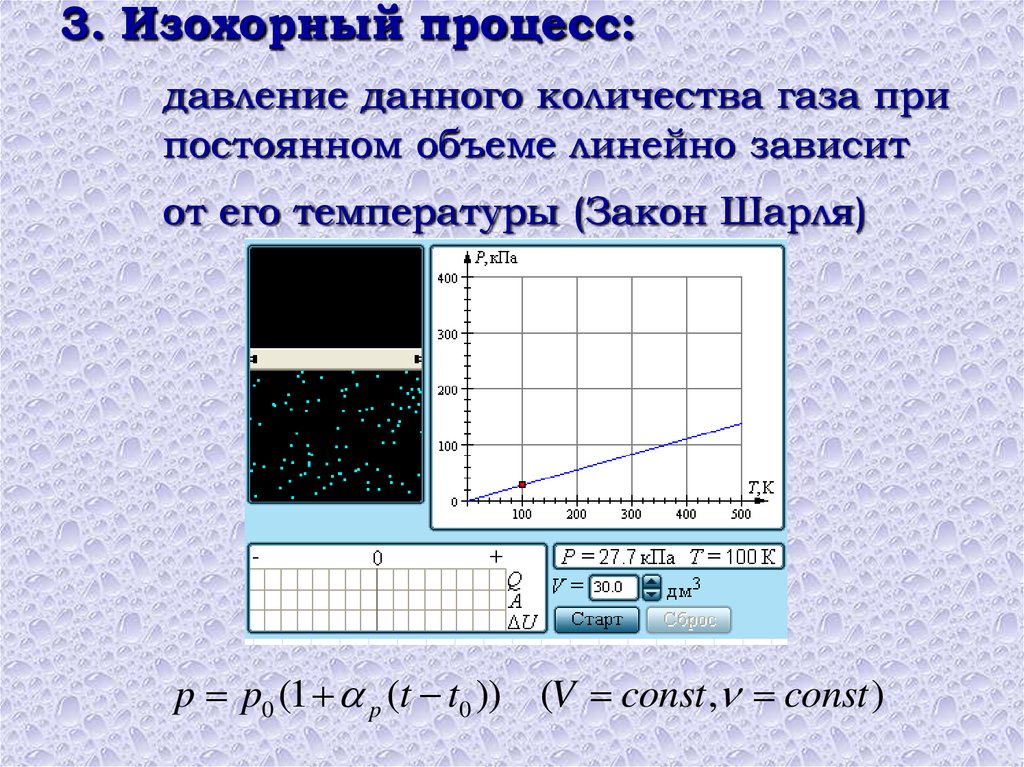
Как объяснить обратную зависимость давления от объёма с физической точки зрения? При постоянной температуре остаётся неизменной средняя кинетическая энергия молекул газа, то есть, попросту говоря, не меняется сила ударов молекул о стенки сосуда. При увеличении объёма концентрация молекул уменьшается, и соответственно уменьшается число ударов молекул в единицу времени на единицу площади стенки — давление газа падает. Наоборот, при уменьшении объёма концентрация молекул возрастает, их удары сыпятся чаще и давление газа увеличивается.
Графики изотермического процесса
Вообще, графики термодинамических процессов принято изображать в следующих системах координат:
• -диаграмма: ось абсцисс , ось ординат ;
• -диаграмма: ось абсцисс , ось ординат ;
• -диаграмма: ось абсцисс , ось ординат .
График изотермического процесса называется изотермой.
Изотерма на -диаграмме — это график обратно пропорциональной зависимости .
Такой график является гиперболой (вспомните алгебру — график функции ). Изотерма-гипербола изображена на рис. 1.
Изотерма-гипербола изображена на рис. 1.
Рис. 1. Изотерма на -диаграмме
Каждая изотерма отвечает определённому фиксированному значению температуры. Оказывается, что чем выше температура, тем выше лежит соответствующая изотерма на —диаграмме.
В самом деле, рассмотрим два изотермических процесса, совершаемых одним и тем же газом (рис. 2). Первый процесс идёт при температуре , второй — при температуре .
Рис. 2. Чем выше температура, тем выше изотерма
Фиксируем некоторое значение объёма . На первой изотерме ему отвечает давление , на второй — . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, .
В оставшихся двух системах координат изотерма выглядит очень просто: это прямая, перпендикулярная оси (рис. 3):
Рис. 3. Изотермы на и -диаграммах
Изобарный процесс
Напомним ещё раз, что изобарный процесс — это процесс, проходящий при постоянном давлении. В ходе изобарного процесса меняются лишь объём газа и его температура.
В ходе изобарного процесса меняются лишь объём газа и его температура.
Типичный пример изобарного процесса: газ находится под массивным поршнем, который может свободно перемещаться. Если масса поршня и поперечное сечение поршня , то давление газа всё время постоянно и равно
где — атмосферное давление.
Пусть идеальный газ совершает изобарный процесс при давлении . Снова рассмотрим два произвольных состояния газа; на этот раз значения макроскопических параметров будут равны и .
Выпишем уравнения состояния:
Поделив их друг на друга, получим:
В принципе, уже и этого могло бы быть достаточно, но мы пойдём немного дальше. Перепишем полученное соотношение так, чтобы в одной части фигурировали только параметры первого состояния, а в другой части — только параметры второго состояния (иными словами, «разнесём индексы» по разным частям):
(4)
А отсюда теперь — ввиду произвольности выбора состояний! — получаем закон Гей-Люссака:
(5)
Иными словами, при постоянном давлении газа его объём прямо пропорционален температуре:
(6)
Почему объём растёт с ростом температуры? При повышении температуры молекулы начинают бить сильнее и приподнимают поршень.
Графики изобарного процесса
График изобарного процесса называется изобарой. На -диаграмме изобара является прямой линией (рис. 4):
Рис. 4. Изобара на -диаграмме
Пунктирный участок графика означает, что в случае реального газа при достаточно низких температурах модель идеального газа (а вместе с ней и закон Гей-Люссака) перестаёт работать. В самом деле, при снижении температуры частицы газа двигаются всё медленнее, и силы межмолекулярного взаимодействия оказывают всё более существенное влияние на их движение (аналогия: медленный мяч легче поймать, чем быстрый). Ну а при совсем уж низких температурах газы и вовсе превращаются в жидкости.
Разберёмся теперь, как меняется положение изобары при изменении давления. Оказывается, что чем больше давление, тем ниже идёт изобара на — диаграмме.
Чтобы убедиться в этом, рассмотрим две изобары с давлениями и (рис. 5):
Рис. 5. Чем ниже изобара, тем больше давление
Зафиксируем некоторое значение температуры . Мы видим, что . Но при фиксированной температуре объём тем меньше, чем больше давление (закон Бойля — Мариотта!).
Стало быть, .
В оставшихся двух системах координат изобара является прямой линией, перпендикулярной оси (рис. 6):
Рис. 6. Изобары на и -диаграммах
Изохорный процесс
Изохорный процесс, напомним, — это процесс, проходящий при постоянном объёме. При изохорном процессе меняются только давление газа и его температура.
Изохорный процесс представить себе очень просто: это процесс, идущий в жёстком сосуде фиксированного объёма (или в цилиндре под поршнем, когда поршень закреплён).
Пусть идеальный газ совершает изохорный процесс в сосуде объёмом . Опять-таки рассмотрим два произвольных состояния газа с параметрами и . Имеем:
Имеем:
Делим эти уравнения друг на друга:
Как и при выводе закона Гей-Люссака, «разносим» индексы в разные части:
(7)
Ввиду произвольности выбора состояний мы приходим к закону Шарля:
(8)
Иными словами, при постоянном объёме газа его давление прямо пропорционально температуре:
(9)
Увеличение давления газа фиксированного объёма при его нагревании — вещь совершенно очевидная с физической точки зрения. Вы сами легко это объясните.
Графики изохорного процесса
График изохорного процесса называется изохорой. На -диаграмме изохора является прямой линией (рис. 7):
Рис. 7. Изохора на -диаграмме
Смысл пунктирного участка тот же: неадекватность модели идеального газа при низких температурах.
Далее, чем больше объём, тем ниже идёт изохора на —диаграмме (рис. 8):
8):
Рис. 8. Чем ниже изохора, тем больше объём
Доказательство аналогично предыдущему. Фиксируем температуру и видим, что . Но при фиксированной температуре давление тем меньше, чем больше объём (снова закон Бойля — Мариотта). Стало быть, .
В оставшихся двух системах координат изохора является прямой линией, перпендикулярной оси (рис. 9):
Рис. 9. Изохоры на и -диаграммах
Законы Бойля — Мариотта, Гей-Люссака и Шарля называются также газовыми законами.
Мы вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
Графика — зависимость — давление
Cтраница 1
Зависимость давления от времени в рассматриваемых точках на нитке № 1. [1]
[1] |
Графики зависимости давления от времени в течение первых 2 5 минут после разрыва в контрольных точках представлены на рис. 5.67. Как видно из графиков, определить возникновение разрыва только по показаниям датчиков давления, расположенных в точках № 1 ( 0 м) и № 4 ( 43 000 м) невозможно. [2]
Построить графики зависимости давления от объема, изображающие изотермический, изобарный и изохорный процессы. [3]
| Давление насыщенного пара воды и ртути при различных температурах ( в мм рт. ст. [4] |
Из графика зависимости давления насыщенного пара воды от температуры ( рис. 481) видно, что приращение давления, соответствующее увеличению температуры на 1 К, растет с температурой. [5]
Номограмма для определения потерь давления при движении воздуха через насадки долота. [6]
[6] |
На рис. 10.2 представлены графики зависимости давления нагнетания от глубины скважины диаметром 200 — 230 мм. [7]
Эти данные приведены на графиках зависимости давления от температуры ( рис. V-31 и V-32, стр. [8]
Как отличаются друг от друга графики зависимости давления от температуры в первом и втором случаях. [9]
| Уменьшение влияния нагрузки на переключение. [10] |
На рис. 106, в приведены графики зависимости давления и расхода срабатывания от высоты уступа на стенке. Как видно, давление срабатывания, соответствующее открытому выходу, при некоторой высоте уступа hi равно давлению срабатывания при заглушенном выходе. В связи с этим использование указанного способа не всегда рационально. [11]
На рис. 14 и 1о приведены графики зависимости давления паров и удельного веса жидкости для низших олефинов ( этена, пропена и бутенов) от температуры. [12]
[12]
| Зависимость давления насыщенного пара воды и льде от температуры. [13] |
На рис. 20 — 26 приведены графики зависимости давления насыщенного пара от температуры для основных элементов периодической системы. [14]
Для газового пространства вниз по потоку график зависимости давления р ( в Па), откладываемого по ординате, от времени ( в с) имеет вид плавной кривой, выходящей из начала координат и вогнутой вверх на. Указанная кривая вскоре асимптотически приближается к прямой линии, которая достаточно хорошо может быть представлена эмпирическим соотношением: р 0 086 ( / — 196), где t — общее время, прошедшее с начала опыта. [15]
Страницы: 1 2 3
Руководство по диаграммам давления и температуры пара
Давление пара может быть определено как давление, создаваемое паром с нисходящей фазой при данной температуре в замкнутой системе. Это делается в состоянии термодинамического равновесия.
Это делается в состоянии термодинамического равновесия.
Мы все видели, как мама заваривала чай или кофе на кухне. Первое, что нужно сделать для приготовления чая, это вскипятить воду. Вскипятить воду может каждый, но если мы попросим вас вскипятить воду быстрее, как вы это сделаете?
Вы можете увеличить огонь, повернув ручку плиты, чтобы увеличить пламя, или второй и самый эффективный способ — закрыть крышку контейнера, чтобы вода быстрее закипела. Давление, которое будет создаваться в емкости, поможет увеличить скорость закипания.
ЧТО ОЗНАЧАЕТ ВЫСОКАЯ ТЕМПЕРАТУРА КИПЕНИЯ?
Высокая температура кипения измеряет температуру, при которой жидкость закипает. Как и в случае с температурой плавления, более высокая температура кипения подразумевает большие межмолекулярные силы и, следовательно, меньшее давление паров.
Источник
КРИВАЯ ДАВЛЕНИЯ ПАРА
- График зависимости температуры от давления пара создан для отслеживания различных точек кипения различных жидкостей.
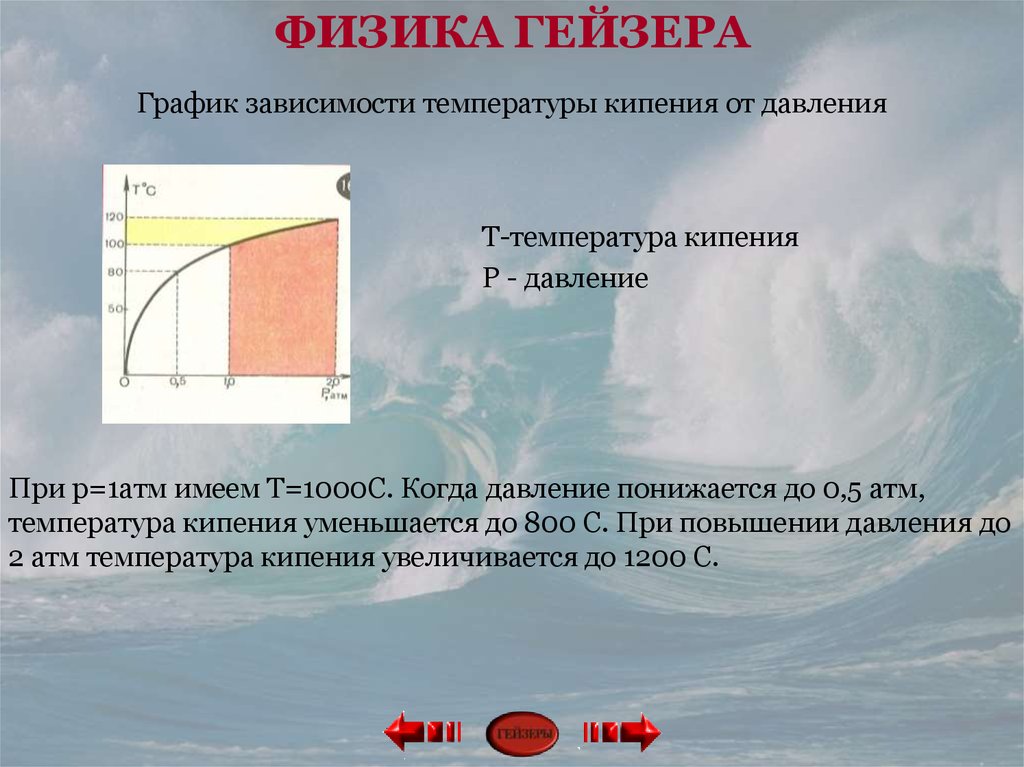
- Из кривых давления пара видно, что разные жидкости имеют разные точки кипения.
- Существует стандарт давления, в соответствии с которым проведена горизонтальная линия, обозначающая давление.
- Температура кипения жидкостей указывает на образование сильных межмолекулярных сил.
- Следовательно, из графика зависимости температуры от давления пара мы получим imf (межмолекулярная сила) и давление пара .
Source
VAPOR PRESSURE FORMULA
First method: Raoult’s law for vapor pressure is as follows:
P solution = X solvent * P solvent
Where,
- P раствор = Давление паров раствора
- х растворитель = мольная доля растворителя
- P растворитель = давление паров чистого растворителя
Второй метод: можно использовать уравнение Клаузиуса-Клапейрона Где,
- ΔH vap : Энтальпия испарения жидкости.

- R: Реальная газовая постоянная, или 8,314 Дж/(К × моль).
- T1: Начальная температура.
- T2: Конечная температура
- P1 и P2: давление паров при температурах T1 и T2 соответственно.
Часто задаваемые вопросы:
1. Какая связь между температурой и давлением паров?
С повышением температуры жидкости молекулы начинают двигаться быстрее. Это приводит к образованию газа, что приводит к увеличению давления пара. Таким образом, температура прямо пропорциональна давлению пара.
2. Как читать график зависимости давления пара от температуры?
Поскольку температура и давление паров прямо пропорциональны друг другу, соответствующий им график будет представлять собой прямую линию.
3. Какой из графиков показывает зависимость между температурой кипения и давлением пара?
Если давление пара высокое, это означает, что межмолекулярные силы низкие. Таким образом, высокая температура не требуется, что приводит к низкой температуре кипения. Поскольку давление пара и температура кипения обратно пропорциональны друг другу, соответствующий им график будет иметь форму гиперболы.
Таким образом, высокая температура не требуется, что приводит к низкой температуре кипения. Поскольку давление пара и температура кипения обратно пропорциональны друг другу, соответствующий им график будет иметь форму гиперболы.
4. Какая связь между точкой кипения, давлением паров и температурой вещества и атмосферным давлением?
Температура кипения регистрируется в момент, когда давление паров жидкости соответствует атмосферному давлению. Таким образом, при повышении температуры температура кипения снижается, но давление пара и атмосферное давление увеличиваются.
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о графике давления пара и температуры ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими учениками, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности — мы обещаем, что это сделает учебу намного веселее! -Давление. Для описания идеального газа делается ряд допущений. 1) Газы состоят из большого количества мельчайших частиц, находящихся далеко друг от друга по сравнению с их размером. Это означает, что молекулы газа имеют пренебрежимо малый объем по сравнению с объемом сосуда, в который они помещены. 2) Столкновения между частицами газа и между частицами и стенками контейнера являются упругими столкновениями (нет чистой потери полной кинетической энергии). 3) Частицы газа находятся в непрерывном, быстром и беспорядочном движении. Следовательно, они обладают кинетической энергией, то есть энергией движения. 4) Силы взаимодействия между частицами газа отсутствуют. Таким образом, они могут двигаться независимо друг от друга. Они взаимодействуют друг с другом только посредством упругих столкновений. 5) Средняя кинетическая энергия частицы газа зависит только от температуры газа. Последний постулат кинетической молекулярной теории гласит, что средняя кинетическая энергия частицы газа зависит только от температуры газа. Если температура представлена в градусах Цельсия, то график между давлением и температурой будет прямой линией, но не будет проходить через начало координат. При экстраполяции график достигнет -273,15 градуса. Газы можно сжимать, потому что большая часть газа состоит из пустого пространства. Если температура и количество газа фиксированы, то давление обратно пропорционально объему, занимаемому газом. Если температура и количество молей газа фиксированы, то график между давлением P и объемом V будет представлять собой прямоугольную гиперболу. При увеличении объема газа давление уменьшается и наоборот. Такой процесс также называется Изотермический процесс Средняя кинетическая энергия частиц в газе пропорциональна температуре газа. Если давление идеального газа поддерживается постоянным, то объем сосуда прямо пропорционален температуре (в градусах Кельвина) газа. График между V и T (в кельвинах), изображающий закон Шарля, будет прямой линией, проходящей через начало координат. Хотя мы никогда не можем уменьшить объем до нуля, поэтому график не должен показываться проходящим через начало координат. По мере увеличения количества частиц газа должна увеличиваться частота столкновений со стенками контейнера. Это, в свою очередь, приводит к увеличению давления газа. Гибкие контейнеры, такие как воздушный шар, будут расширяться до тех пор, пока давление газа внутри воздушного шара снова не уравновесит давление газа снаружи. Таким образом, объем газа пропорционален количеству частиц газа. Если давление и температура идеального газа поддерживаются постоянными, то объем сосуда прямо пропорционален количеству газа (количеству молей газа) в сосуде. Представьте, что произойдет, если в контейнер добавить газы с разным давлением, но одинаковой температурой. Общее давление увеличилось бы, потому что было бы больше столкновений со стенками контейнера. В сосуде так много пустого пространства, что молекулы каждого типа газа ударяются о стенки сосуда в смеси так же часто, как и тогда, когда был только один вид газа. Общее давление смеси газов равно сумме парциальных давлений отдельных газов. It был впервые сформулирован Эмилем Клапейроном в 1834 году как комбинация закона Бойля, закона Шарля и закона Авогадро.
Закон идеального газа часто записывается как: PV=nRTPV=nRT PV=nRT Где RRR — газовая постоянная. Некоторые значения RRR приведены ниже. 9{-1}м3.атм.моль−1K−1 По состоянию на 7 марта 2022 г.
По состоянию на 7 марта 2022 г. Закон идеального газа | Brilliant Math & Science Wiki
Содержание

 Таким образом, средняя кинетическая энергия частиц газа увеличивается по мере нагревания газа. Поскольку масса этих частиц постоянна, их кинетическая энергия может увеличиваться только при увеличении средней скорости частиц. Чем быстрее движутся эти частицы, когда они ударяются о стену, тем большую силу они оказывают на стену. Поскольку сила, приходящаяся на одно столкновение, увеличивается с повышением температуры, давление газа также должно увеличиваться.
P∝TP \ propto TP∝T
Таким образом, средняя кинетическая энергия частиц газа увеличивается по мере нагревания газа. Поскольку масса этих частиц постоянна, их кинетическая энергия может увеличиваться только при увеличении средней скорости частиц. Чем быстрее движутся эти частицы, когда они ударяются о стену, тем большую силу они оказывают на стену. Поскольку сила, приходящаяся на одно столкновение, увеличивается с повышением температуры, давление газа также должно увеличиваться.
P∝TP \ propto TP∝T
Здесь P — давление, а T — температура в градусах Кельвина.
При этом объем и количество молей газа принимаются постоянными.
Если температура представлена в кельвинах, то график между давлением и температурой будет прямой линией, проходящей через начало координат.  Если мы сжимаем газ без изменения его температуры, средняя кинетическая энергия частиц газа остается неизменной. Скорость движения частиц не меняется, но контейнер становится меньше. Таким образом, частицы перемещаются от одного конца контейнера к другому за более короткий период времени. Это значит, что они чаще ударяются о стены. Любое увеличение частоты столкновений со стенками должно приводить к увеличению давления газа. Таким образом, давление газа становится больше, когда объем газа становится меньше.
Если мы сжимаем газ без изменения его температуры, средняя кинетическая энергия частиц газа остается неизменной. Скорость движения частиц не меняется, но контейнер становится меньше. Таким образом, частицы перемещаются от одного конца контейнера к другому за более короткий период времени. Это значит, что они чаще ударяются о стены. Любое увеличение частоты столкновений со стенками должно приводить к увеличению давления газа. Таким образом, давление газа становится больше, когда объем газа становится меньше.
P∝1/VP \propto 1/VP∝1/V
Здесь P — давление, а V — объем.  Поскольку масса этих частиц постоянна, частицы должны двигаться быстрее по мере нагревания газа. Если они будут двигаться быстрее, частицы будут воздействовать на контейнер с большей силой каждый раз, когда они ударяются о стенки, что приводит к увеличению давления газа. Если стенки сосуда гибкие, он будет расширяться до тех пор, пока давление газа снова не уравновесит давление атмосферы. Таким образом, объем газа увеличивается по мере увеличения температуры газа.
Поскольку масса этих частиц постоянна, частицы должны двигаться быстрее по мере нагревания газа. Если они будут двигаться быстрее, частицы будут воздействовать на контейнер с большей силой каждый раз, когда они ударяются о стенки, что приводит к увеличению давления газа. Если стенки сосуда гибкие, он будет расширяться до тех пор, пока давление газа снова не уравновесит давление атмосферы. Таким образом, объем газа увеличивается по мере увеличения температуры газа.
V∝TV \propto TV∝T
Здесь V – объем контейнера, а T – температура газа в Кельвинах. 9\ circ −273 ∘ C
9\ circ −273 ∘ C
В∝NV \пропто NV∝N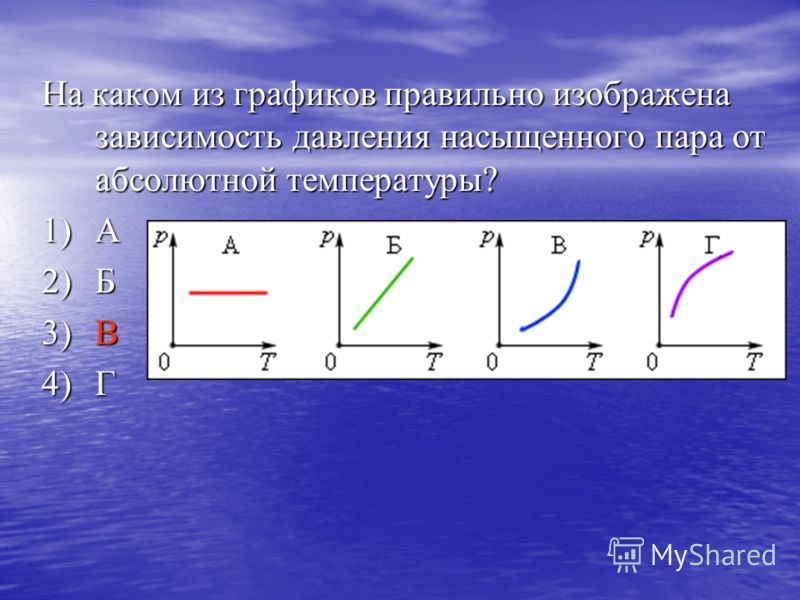 Общее давление будет увеличиваться по мере того, как большее количество молекул газа ударяется о стенки контейнера, но давление, создаваемое отдельными молекулами газа, остается прежним. Таким образом, общее число столкновений со стенкой в этой смеси равно сумме столкновений, которые произошли бы, когда каждый газ присутствует сам по себе. Другими словами,
Общее давление будет увеличиваться по мере того, как большее количество молекул газа ударяется о стенки контейнера, но давление, создаваемое отдельными молекулами газа, остается прежним. Таким образом, общее число столкновений со стенкой в этой смеси равно сумме столкновений, которые произошли бы, когда каждый газ присутствует сам по себе. Другими словами,
Pt=P1+P2+P3+…{P_t} = {P_1} + {P_2} + {P_3} + …Pt=P1+P2+P3+… Газ при 27°C имеет объем V и давление P. При нагревании его давление удваивается, а объем увеличивается в три раза.

