на сколько градусов нагреется 300г воды если она получит всю энергию выделившуюся при остывании 2,5кг меди от температуры 140 градусов до температуры 40 градусов
Последние вопросы
Физика
1 час назад
1. Як зміниться сила гравітаційної взаємодії між двома точковими тілами, якщо відстань між ними збільшиться в 5 разів? 1б. 2. Значення прискорення вільного прискорення залежить… 1б. 3. При збільшенні відстані від поверхні Землі прискорення вільного падіння… 1б. 4. Як зміниться сила взаємодії між двома тілами, якщо масу одного з них збільшити в 2 рази, а відстань між ними зменшити в 2 рази? 1б. 5.Яка сила тяжіння діє на Землі на тіло, маса якого 750 г? (малюнок — зобразити силу тяжіння)! 1б. 6. Визначити прискорення вільного падіння для Венери, якщо її маса дорівнює 4,87*1(0(24) кг, радіус 6,05*10(6) м 2б. 7. Прискорення вільного падіння на поверхні Місяця приблизно дорівнює 1,63 м/с2, а середній радіус 1,73*10(6 )м. Яка маса Місяця? 2б.
8. Космічний корабель масою 8 т наближається до орбітальної станції масою 20 т на відстань 100 м. Знайдіть
силу їх взаємного притягання.
Яка маса Місяця? 2б.
8. Космічний корабель масою 8 т наближається до орбітальної станції масою 20 т на відстань 100 м. Знайдіть
силу їх взаємного притягання.Физика
4 часа назад
2). Мідний дріт довжиною 250 м має опір 0,68 Ом. Якою є площа поперечного перерізу дроту?Физика
4 часа назад
1). Якій опір має відрізок алюмінієвого дроту довжиною 1962,5 м, якщо радіус перерізу проволоки становить г = 2,5 мм? Площа круга: S = nr2 (це друга степінь).Физика
5 часов назад
Задача по физике 8 класс, помогите решить!- Физика
5 часов назад
Физика, вопрос по цепям Физика
5 часов назад
Такий стан тіла, за якого тіло не діє на опору чи підвіс О а) Деформація О б) Інертність О в) Невагомість О г) ІнерціяФизика
6 часов назад
Физика! Помогите, пожалуйста! Все возможные формулы перепробовала, а ответ не совпадает.
Физика
6 часов назад
Опыт круговорот воды в природеФизика
6 часов назад
Помогите пожалуйста физикаФизика
6 часов назад
Задача по физикеФизика
7 часов назад
Вопрос по физикеФизика
7 часов назад
Подайте тиск 200 кПа у міліметрах ртутного стовпа.
-
Физика
7 часов назад
Физика 7 класс Физика
7 часов назад
Что такое разность потенциалов простыми словами?Физика
8 часов назад
Основной закон динамики который позволяет вычислить силу из выражения?
Все предметы
Выберите язык и регион
English
United States
Polski
Polska
Português
Brasil
English
Türkçe
Türkiye
English
Philippines
Español
España
Bahasa Indonesia
Indonesia
Русский
Россия
How much to ban the user?
1 hour 1 day 100 years
Сайт учителя — Расчет количества теплоты.
 Задания уровня «В».
Задания уровня «В».Расчет количества теплоты.
Задания уровня «В».
1. Температура свинцовой детали массой 400 г равна 235°С. Какое количество теплоты она передает окружающим телам, охлаждаясь до температуры 25°С?
2. На сколько градусов остынет в питьевом баке емкостью 10 л кипяток, если он отдаст в окружающее пространство 2 МДж теплоты?
3. Рассчитайте массу железной детали, если для ее нагревания от температуры 20°С до температуры 200°С потребовалось 20,7 кДж теплоты.
4. Нагреется ли 2,5 л воды от температуры 20°С до 100°С, если ее внутренняя энергия увеличилась на 500 кДж?
5. При обработке холодом стальную деталь массой 540 г при температуре 20°С поместили в холодильник, температура которого равна 80°С. Какое количество теплоты выделилось при охлаждении детали?
6. Какое количество теплоты потребуется для нагревания на 18°С воздуха в комнате, размеры которой 4 м х 5 м х 2,5 м? Сколько воды можно нагреть этой же теплотой на такое же число градусов?
7. Определите, какое количество теплоты необходимо для нагревания 50 г растительного масла от температуры 15°С до 115°С, налитого в чугунную сковородку массой 1,25 кг.
Определите, какое количество теплоты необходимо для нагревания 50 г растительного масла от температуры 15°С до 115°С, налитого в чугунную сковородку массой 1,25 кг.
8. Какое количество теплоты потребуется для нагревания 1,6 л воды в алюминиевом чайнике массой 750 г от температуры 20°С до 80°С?
9. Рассчитайте первоначальную температуру куска меди массой 1,2 кг, если при его охлаждении до температуры 20°С выделилось 115 кДж теплоты.
10. Определите количество теплоты, которое потребуется для нагревания 15 л воды в железном котле массой 4,5 кг от температуры 15°С до температуры 100°С.
11. На нагревание кирпича массой 4 кг на 63 °С затрачено такое же количество теплоты, как и на нагревание той же массы воды на 13,2°С. Какова удельная теплоемкость кирпича?
12. На сколько градусов нагреется медный брусок массой 2 кг, если он получит всю внутреннюю энергию, выделившуюся при остывании 200 г воды от температуры 100°С до температуры 20°С?
13. Алюминиевый бидон массой 10 кг вмещает 30 л молока. Какое количество теплоты потребуется для нагревания молока в бидоне от 0°С до температуры 70°С (пастеризация)?
Алюминиевый бидон массой 10 кг вмещает 30 л молока. Какое количество теплоты потребуется для нагревания молока в бидоне от 0°С до температуры 70°С (пастеризация)?
14. Рассчитайте количество теплоты, которое потребуется для нагревания смеси, состоящей из 500 г воды и 100 г спирта от температуры 20°С до температуры 60°С.
15. Какое количество теплоты потребуется для нагревания 2,3 кг воды в медной кастрюле массой 1,6 кг от температуры 10°С до температуры 100°С?
16. Какое количество теплоты выделится при полном сгорании 300 г спирта? Сколько воды можно нагреть на 60°С этим теплом?
17. Определите количество теплоты, которое выделится при полном сгорании топлива, полученного при смешивании бензина массой 2 кг и керосина массой 3 кг.
18. Каким количеством природного газа можно заменить 2 г водорода, чтобы получить такое же количество теплоты, что и при сжигании водорода?
19. Какое количество теплоты выделится при полном сгорании 1 т каменного угля? Каким количеством торфа можно заменить этот уголь?
Какое количество теплоты выделится при полном сгорании 1 т каменного угля? Каким количеством торфа можно заменить этот уголь?
20. Сколько бензина нужно сжечь, чтобы получить столько же энергии, сколько ее выделяется при полном сгорании 4 кг каменного угля?
21. На сколько градусов нагреется 5 кг воды при сжигании 25 г каменного угля, если считать, что вся энергия, выделенная при сгорании угля, пойдет на нагрев воды?
22. Какова масса дров, которая потребуется для нагрева 20 л воды от температуры 30°С до температуры 100°С? Потерями тепла пренебречь.
23. Определите, какое количество воды можно нагреть на 40°С теплом, выделившимся при полном сгорании 10 г керосина, если не учитывать потерь тепла.
24. Какое количество каменного угля необходимо сжечь, чтобы получить такое же количество теплоты, как и при сгорании 3 л керосина?
25. Какое количество спирта потребуется для того, чтобы нагреть 3 кг воды, взятой при температуре 20°С, до 100°С? Считать, что вся энергия, полученная при сгорании спирта, пойдет на нагрев воды.
Конечная температура после смешивания двух количеств воды: задачи 1
Конечная температура после смешивания двух количеств воды: задачи 1–10Когда две пробы воды смешиваются, каковы конечные результаты температуры?
Проблемы 1 — 10
Перейти к смешиванию двух количеств воды
Рабочий лист №2
Назад в меню термохимии
Задача №1: Определите конечную температуру, когда 10,0 г пара при 100,0 °C смешиваются с 500,0 г воды при 25,0 °C.
Решение:
Эта задача аналогична задачам 9 и 10 в рабочем листе №2 с одним отличием. В примере задачи есть пар, а в задаче на листе есть лед. ЕДИНСТВЕННЫЕ различия — это используемые числа и тот факт, что лед связан с «холодной водой» в уравнении. Техники те же.
«Теплая вода» в этом случае выполняет две функции:
а) в виде газа конденсируется при 100,0 °C в жидкую воду
б) в виде жидкости температура понижается на неизвестную величину
Более холодная вода получит всю энергию для этого. Имея в виду, что тепло, отдаваемое более теплым, должно быть равно теплу, полученному более холодным, мы имеем это:
Имея в виду, что тепло, отдаваемое более теплым, должно быть равно теплу, полученному более холодным, мы имеем это:
тепло, отдаваемое более холодной воде при конденсации пара + теплота, используемая для нагрева более холодной воды = теплота, получаемая более холодной водой
Еще раз обратите внимание, что есть ДВА источника тепловой энергии (конденсация пара, затем охлаждение теплой воды). Общая энергия, потерянная обоими, будет равна тепловой энергии, полученной более холодной водой.
Вот цифры:
[(40700)(10,0/18,0)] + [(10)(100 − x)(4,18)] = (500,0)(x − 25)(4,18)
Замечание Я использовал 40700 Дж, а не 40,7 кДж для молярной теплоты парообразования.
Продолжая решение, я получаю:
2131,8х = 79041,11
и так, х = 37,1 °С.
Имейте в виду, что «x» обозначает конечную температуру, а НЕ Δt.
Также я решил эту проблему с 4.18. Выполнение этого с 4.184 дает немного другие цифры. Убедитесь, что вы согласовали со своим учителем значения различных констант, которые он/она хочет, чтобы вы использовали.
Убедитесь, что вы согласовали со своим учителем значения различных констант, которые он/она хочет, чтобы вы использовали.
Задача № 2: Определите конечную температуру, когда 18,0 г льда при -10,0 °C смешиваются с 275,0 г воды при 60,0 °C.
Решение:
Это похоже на задачу 8e и несколько последующих в Рабочем листе №2.
«Холодная вода» в этом случае будет выполнять три функции:
а) в твердом состоянии нагреть от -10 до нуля
б) все 18 г расплавятся
в) в жидком состоянии температура повысится на неизвестную величину
Более теплая вода должна обеспечить всю энергию для этого. Имея в виду, что тепло, потерянное более теплым, должно быть равно теплу, полученному более холодным (q потеряли = q получили ), мы имеем это:
теплота для нагревания льда на 10 градусов + теплота для таяния льда + теплота для нагревания холодной воды на неизвестную величину = потери тепла теплой водой
Вот цифры:
[(18) (10) (2,06)] + [(6020) (18,0/18,0)] + [(18) (x − 0) (4,184)] = (275,0) (60,0 − x) (4,184)
Примечание.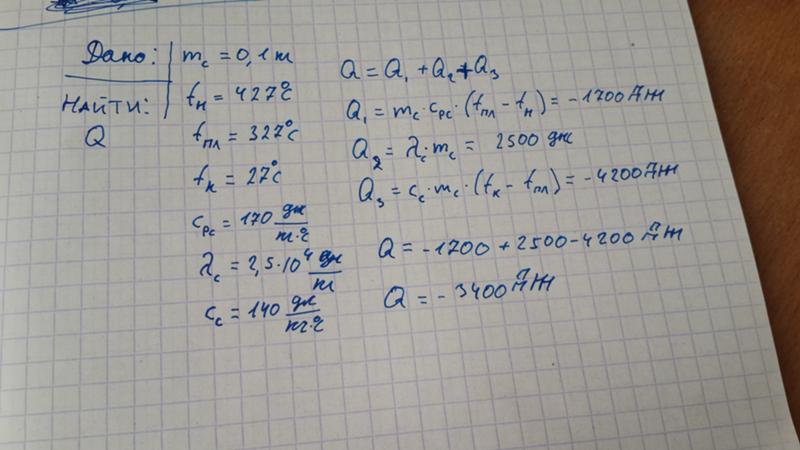 Я использовал 6020 Дж, а не 6,02 кДж для молярной теплоты плавления. Это потому, что две другие части левой части уравнения дадут ответ в джоулях. Я использовал 6020, чтобы все три части были в джоулях. Если бы я использовал 6,02, то эта средняя часть была бы в единицах кДж.
Я использовал 6020 Дж, а не 6,02 кДж для молярной теплоты плавления. Это потому, что две другие части левой части уравнения дадут ответ в джоулях. Я использовал 6020, чтобы все три части были в джоулях. Если бы я использовал 6,02, то эта средняя часть была бы в единицах кДж.
Обратите внимание на использование x — 0 и 60.0 — x. На этот раз визуализируйте (или запишите) числовую прямую, использованную выше. Ноль находится слева, 60,0 справа, а x находится между 0 и 60,0.
Продолжая решение, я получаю:
1225,912x = 62945,2
и так, х = 51,3 °С.
Имейте в виду, что «x» обозначает конечную температуру, а НЕ Δt.
Задача №3: 55,0 мл этанола (d = 0,789 г/мл) при 8,0 °C смешивают с 55,0 мл воды при 28,2 °C. Какова конечная температура смеси, если тепло не теряется?
Решение:
Сначала необходимо сделать две вещи: (1) определить, сколько граммов этанола присутствует, и (2) определить удельную теплоемкость этанола.
55,0 мл, умноженное на плотность (0,789 г/мл), дает массу присутствующего этанола. Это значение составляет 43,395 г. Я буду использовать это значение и округлю его в конце расчета.
Удельную теплотворную способность необходимо посмотреть в Интернете. Наиболее часто встречающееся при поиске значение 2,44 Дж г¯ 1 °C¯ 1 , так что мы будем использовать его.
Приравняв ‘x’ к конечной температуре, мы получим следующее:
(43,395) (х — 8,0) (2,44) = (55,0) (28,2 — х) (4,184)
Вы можете закончить эту задачу.
Задача №4: 900,0 л пальмового масла при 47,0 °C смешивают с 200,0 л пальмового масла при 76,0 °C. Какая конечная температура? Предположим, что тепло не уходит в окружающую среду.
Решение:
Обратите внимание, что для пальмового масла не указана удельная теплоемкость. Именно потому, что никто не нужен. Кроме того, небольшое расследование в Интернете показывает, что плотность пальмового масла составляет около 0,9. г/см 3 .
г/см 3 .
1) Переведем 900,0 л и 200,0 л в граммы, используя плотность:
(900 000 мл) (0,9 г/см 3 ) = 8,10 x 10 5 г(200 000 мл) (0,9 г/см 3 ) = 1,80 x 10 5 г
Помните, что 1 мл равен 1 см 3 .
2) Пусть ‘x’ равняется конечной температуре, поэтому два изменения температуры:
900 литров нагреваются, поэтому используйте ‘x − 47,0’200 л нагреваются, поэтому используйте ‘76.0 − x’
3) Имея в виду, что тепло, отдаваемое 200 л, равно теплу, получаемому 900 л, запишем:
(1,80 х 10 5 ) (76,0 — х) = (8,10 х 10 5 ) (х — 47,0)х = 52,3 °С
Я не записал значения удельной теплоемкости, потому что они просто компенсируются. Это потому, что у нас есть пальмовое масло с обеих сторон уравнения. Если бы вещества были разными (см. примеры выше), необходимо было бы включить две удельные теплоемкости.
Кроме того, когда я решал эту задачу на калькуляторе, я отбрасывал часть массы 10 5 . Кроме того, если вы проигнорируете использование плотности и используете, скажем, 200 и 900, вы получите ответ 51,0 ° C.
Задача №5: 364 г воды при 34,0 °C добавляют к льду при 0,0 °C. Если конечная температура системы (которую вы можете считать изолированной) равна 0,0 °C, определите, сколько льда растаяло. Удельная теплоемкость воды 4186 Дж/кг ⋅ °С. Скрытая теплота плавления воды составляет 335 000 Дж/кг.
Решение:
1) Определить потери энергии с теплой водой:
q = (масса) (Δt) (C p )q = (0,364 кг) (34,0 °C) (4186 Дж/кг ⋅ °C)
q = 51805,936 Дж
2) Определить, сколько льда растает на 51805,936 Дж:
51805,936 Дж / 335 000 Дж/кг = 0,155 кг = 155 г (до трех цифр)
Задача № 6: Сколько льда (в граммах) нужно растопить, чтобы понизить температуру 353,0 мл воды с 26,0 °C до 6,0 °C?
Решение:
1) Определить потери тепла охлаждающей водой от 26,0 до 6,0:
q = (353,0 г) (20,0 °С) (4,184 Дж г¯ 1 °С¯ 1 )q = 29539,04 Дж
Обратите внимание на плавное преобразование объема воды в массу воды с использованием плотности 1,00 г/мл.
2) Тепло, потерянное теплой водой, делает две вещи:
а) растопить неизвестную массу льда
б) взять такую же массу растаявшего льда от нуля Цельсия до 6 °С
3) Мы можем выразить это так:
29539,04 Дж = (6020 Дж/моль) (x / 18,015 г/моль) + (x) (6,0 °C) (4,184 Дж·г¯ 1 °C¯ 1 )29539,04 Дж = 334,166х + 25,104х
х = 82,2 г
Задача №7: Неизвестный объем воды при 18,2 °C добавляют к 27,8 мл воды при 33,6 °C. Если конечная температура равна 23,5°С, то каков был неизвестный объем? (Предположим, что тепло не передается в окружающую среду; плотность воды равна 1,00 г/мл.)
Решение:
Обратите внимание, что в этой задаче ‘x’ будет неизвестной массой воды. Поскольку мы знаем начальную температуру и конечную температуру, мы можем рассчитать значения Δt.
1) Рассчитайте два значения Δt:
холодная вода ⇒ 23,5 − 18,2 = 5,2.
теплая вода ⇒ 33,6 − 23,5 = 10,1

2) q потеря = q выигрыш :
(х) (5,3) (4,184) = (27,8) (10,1) (4,184)5,3х = 280,78
х = 53,0 г
Это 53,0 мл воды.
Задача №8: Студент смешал 6,00 г льда при температуре -3,4 °C с 1,00 г пара при температуре 103,0 °C. Какова конечная температура этой смеси?
Решение:
тепло, полученное при нагревании = тепло, потерянное при охлаждениитеплота, получаемая льдом + теплота для таяния льда + теплота для повышения температуры воды = теплота, отдаваемая паром + теплота, теряемая при конденсации пара + теплота, теряемая при охлаждении воды
(6,00 г) (3,4 °C) (2,06 Дж/г °C) + (6,00 г / 18,0 г/моль) (6020 Дж/моль) + (6,00 г) (x − 0 °C) (4,184 Дж /г °С) = (1,00 г) (3,0 °С) (2,02 Дж/г °С) + (1,00 г / 18,0 г/моль) (40700 Дж/моль) + (1,00 г) (100 — х °С) ) (4,184 Дж/г °С)
42,024 + 2006,667 + 25,104х = 6,06 + 2261,11 + 418,4 — 4,184х
29,288х = 636,879
х = 21,7 °С
Задача № 9: Кубик льда достают из морозильной камеры при температуре -5,5 °C и помещают в 98,0-граммовый алюминиевый калориметр, наполненный 326,0 г воды при комнатной температуре 20,0 °C. Конечная ситуация наблюдается, когда вся вода имеет температуру 15,0 °C. Какова была масса кубика льда?
Конечная ситуация наблюдается, когда вся вода имеет температуру 15,0 °C. Какова была масса кубика льда?
Решение:
1) Лед делает три вещи:
(а) нагрев от -5,5 до 0
(б) плавится при 0
(c) подогрев от 0 до 15
2) Три расчета:
q a = (x) (5,5 °C) (2,02 Дж/г °C)
q b = (x / 18,015 г/моль) (6,02 кДж/моль)
q c = (x) (15,0 °C) (4,184 Дж/г °C)
3) Вода и калориметр делают следующее:
(d) вода —> охлаждение с 20 до 15
(e) калориметр —> охлаждение с 20 до 15
3) Два расчета:
q d = (326,0 г) (5,0°C) (4,184 Дж/г°C)
q e = (98,0 г) (5,0 °C) (0,900 Дж/г °C)
4) Количество тепла, поглощаемого льдом, равно количеству тепла, теряемому водой и алюминиевым калориметром:
q a + q b + q c = q d + q eОднако необходимо сделать нечто важное, и это связано с q b .
(x) (5,5°C) (2,02 Дж/г°C) + (x/18,015 г/моль) (6020 Дж/моль) + (x) (15,0°C) (4,184 Дж/г°C) = (326,0 г) (5,0 °С) (4,184 Дж/г °С) + (98,0 г) (5,0 °С) (0,900 Дж/г °С)
Я изменил 6,02 кДж/моль на 6020 Дж/моль.
5) Отделка:
11,11х + 334,166х + 62,76х = 6819,92 + 441408,036х = 7260,92
х = 17,8 г
Задача № 10: 20,0 г пара при 100,0 °C барботируют в смесь 50,0 г воды и 200,0 г льда при температуре ровно 0 °C. Весь пар конденсируется в воду. Каков состав системы в итоге?
Скрытая теплота плавления льда = 334,16 Дж/г
Скрытая теплота парообразования воды = 2259,2 Дж/г
Решение:
1) Сконденсируем 20,0 г пара и охладим его до нуля:
(20,0 г) (2259,2 Дж/) = 45184 Дж
(20,0 г) (100 °C) (4,184 Дж/г °C) = 8368 Дж45184 + 8368 = 53552 Дж
2) Теперь у нас есть система из 70,0 г воды при 0 °C и 200,0 г льда с 53552 Дж, «плавающими» вокруг. (70,0 получается из уже имеющихся 50,0 плюс 20,0 сконденсировавшегося пара.) Посмотрим, сколько льда растопит 53552 Дж:
(70,0 получается из уже имеющихся 50,0 плюс 20,0 сконденсировавшегося пара.) Посмотрим, сколько льда растопит 53552 Дж:
53552 Дж / 334,16 Дж/г = 160,26 г
3) Сколько льда осталось?
200,0 г − 160,3 г = 39,7 г4) Сколько жидкости присутствует?
70,0 г + 160,3 г = 230,3 гЗадача №11: Предположим, что 35,46 г льда при температуре -6,8 °C помещены в 69,12 г воды при температуре 91,0 °C в идеально изолированном сосуде. Рассчитайте конечную температуру. (Молярная теплоемкость льда 37,5 Дж К¯ 1 моль¯ 1 , жидкой воды 75,3 Дж К¯ 1 моль¯ 1 . Молярная энтальпия плавления льда равна 6,01 кДж/моль.)
Решение:
1) Лед будет поглощать энергию теплой воды. Полученная энергия заставляет лед делать три вещи:
1) нагрев от минус 6,8 °С до 0 °С
2) плавится при 0 °C 3) нагрев от 0°С до конечной температуры2) Вот уравнения для трех характеристик поведения льда с набором энергии:
q 1 = (35,46 г / 18,0 г/моль) (6,8 °C) (37,5 Дж К¯ 1 моль¯ 1 ) q 2 = (35,46 г / 18,0 г/моль) (6010 Дж/моль) q 3 = (35,46 г / 18,0 г/моль) (x − 0 °C) (75,3 Дж К¯ 1 моль¯ 1 )3) Теплая вода остынет (теряет энергию).
Вот уравнение охлаждения теплой воды:
q 4 = (69,12 г / 18,0 г/моль) (91,0 °C − x) (75,3 Дж K¯ 1 моль¯ 1 )4) Вы решаете это уравнение:
q 1 + q 2 + q 3 = q 4Обратите внимание, что использовалась только одна переменная. «x» — конечная температура.
5) Подставьте в приведенное выше и сделайте немного алгебры.
[(35,46/18,0) (6,8) (37,5)] + [(35,46/18,0) (6010)] + [(35,46/18,0) (x) (75,3)] = (69,12/18,0) (91,0 °C − х) (75,3)[(1,97) (6,8) (37,5)] + [(1,97) (6010)] + [(1,97) (х) (75,3)] = (3,84) (91,0 — х) (75,3)
502,35 + 11839,7 + 148,341х = 26312,832 — 289,152х
437,493х = 13970,782
х = 31,9 °С
6) Два комментария:
1) Я изменил 6,01 кДж/моль на 6010 Дж/моль, чтобы привести все единицы к Джоулям.
2) Я проигнорировал проблемы с °C и K для температуры.Это потому, что все задействованные температуры являются изменениями температуры, а не одной фиксированной температурой. Поскольку 1 °C имеет тот же размер, что и 1 K, все аннулируется.
Задача №12: Кубик льда весом 40,0 г при температуре -19,0 °C помещают в 275 г воды при температуре 25,0 °C. Предполагая, что энергия не передается в окружающую среду или из нее, рассчитайте конечную температуру воды после того, как весь лед растает.
Необходимая информация:
Теплоемкость H 2 O(s) = 37,7 Дж/(моль K)
Теплоемкость H 2 O(л) = 75,3 Дж/(моль К)
Энтальпия плавления H 2 O = 6,02 кДж/мольРешение:
1) Кубик льда делает три вещи:
(а) нагрев от -19 до нуля С
(б) расплав при нуле С
(c) нагрев от нуля до конечной температуры2) Жидкая вода делает одно дело. Он охлаждается с 25,0 °C до конечной темп.
3) Теплота, полученная льдом, равна теплоте, потерянной водой с температурой 25,0 °C.
4) Энергия кубика льда:
q a = (40,0 г / 18,0 г/моль) (19 К) (37,7 Дж/(моль К))
q b = (40,0 г / 18,0 г/моль) (6020 Дж/моль) q c = (40,0 г / 18,0 г/моль) (x − 0) (75,3 Дж/(моль K))5) Вода с температурой 25,0 °C делает следующее:
q d = (275 г / 18,0 г/моль) (25 − x) (75,3 Дж/(моль К))Этот срок:
(25 — х)
— это изменение температуры от 25 до конечной температуры. Я поставил x − 0 в другом, чтобы было ясно, что это изменение x по сравнению с начальной температурой 0.
6) Нам нужна такая установка:
q a + q b + q c = q d(40,0 г/18,0 г/моль) (19 K) (37,7 Дж/(моль K)) + (40,0 г/18,0 г/моль) (6020 Дж/моль) + (40,0 г / 18,0 г/моль) (x − 0) (75,3 Дж/(моль K)) = (275 г / 18,0 г/моль) (25 − x) ( 75,3 Дж/(моль К))
1591,78 + 13377,78 + 167,33х = 28760,42 — 1150,42х
1317,75х = 13790,86
х = 10,5°С
Задача № 13: 200-граммовый жидкий образец спирта X готовят при температуре -10,0 °C.
Затем образец добавляют к 300 г воды при 20,0°С в герметичном контейнере из пенопласта. При достижении термического равновесия температура водно-спиртового раствора составляет 10,0 °С. Какова удельная теплоемкость спирта? Предположим, что герметичный контейнер является изолированной системой. Удельная теплоемкость воды 4,184 кДж кг¯ 1 °С¯ 1 .
Решение:
1) Основное допущение состоит в том, что все тепло, теряемое более теплой водой, передается более холодному спирту. В уравнении:
q вода = q спиртили
(масса воды) (изменение температуры воды) (удельная теплоемкость воды) = (масса спирта) (изменение температуры спирта) (удельная теплоемкость спирта)
2) Энергия, потерянная водой:
(0,300 кг) (10,0 °C) (4,184 кДж кг¯ 1 °C¯ 1 ) = 12,552 кДж3) 12,552 кДж приобретет спирт:
12,552 кДж = (0,200 кг) (20,0 °С) (х)x = 3,1375 кДж кг¯ 1 °C¯ 1
До трех значащих цифр ответ равен 3,14 кДж кг¯ 1 °C¯ 1
4) Часто шаги 2 и 3 выше объединяются следующим образом:
(0,300 кг) (10,0 °C) (4,184 кДж кг¯ 1 °С¯ 1 ) = (0,200 кг) (20,0 °С) (х)Задача №14: Образец воды массой 41,58 г при температуре 73,3 °C добавляют к образцу воды при температуре 23,6 °C в калориметре постоянного давления.
Если конечная температура объединенной воды составляет 38,9 °С, а теплоемкость калориметра равна 26,3 Дж °С¯ 1 , рассчитайте массу воды, первоначально находившейся в калориметре.
Решение:
1) Энергия теплой воды делает две вещи:
(a) нагреть охлаждающую воду с 23,6 °C до 38,9 °C
(b) нагреть калориметр с 23,6 °С до 38,9 °С2) При этом температура более теплой воды упадет с 73,3 °С до 38,9 °С. Поскольку более теплая вода является единственным источником тепловой энергии, определим, сколько тепла теряется:
q = (масса) (изменение температуры) (удельная теплоемкость)q = (41,58 г) (34,4 °С) (4,184 Дж г¯ 1 °С¯ 1 ) = 5984,59 Дж
3) Начиная с шага 1 выше, вот настройки для (a) и (b):
q a = (m) (15,3 °C) (4,184 Дж г¯ 1 °C¯ 1 )
q b = (26,3 Дж °С¯ 1 ) (15,3 °С) = 402,39 Дж4) Сумма (а) и (б) равна 5984,59 Дж:
5984,59 Дж = (м) (15,3 °С) (4,184 Дж г¯ 1 °С¯ 1 ) + 402,39 Дж64,0152 м = 5582,2
м = 87,2 г (до трех знаков фиг.
)
Задача №15: Смешать равные массы горячей воды и льда. Весь лед тает, и конечная температура смеси равна 0°С. Если лед изначально имел температуру 0 °C, какова была первоначальная температура горячей воды?
Решение:
1) Предположим, у нас есть 18,0 г льда и 18,0 г горячей воды.
2) Ключ в том, чтобы понять, что единственное, что сделал лед, это растаял, он не изменил свою температуру. Итак, рассчитаем количество тепла, необходимое для плавления наших 18,0 г (или 1,00 моль) льда:
q = (6,02 кДж/моль) (1,00 моль) = 6,02 кДж3) Единственным источником тепла является горячая вода, дающая 6020 Дж (я перевел 6,02 кДж в Дж) тепла. Рассчитаем изменение температуры 18,0 г горячей воды при потере ею 6020 Дж теплоты:
6020 Дж = (18,0 г) (x) (4,184 Дж г¯ 1 °С¯ 1 )х = 79,9 °С
Горячая вода имела начальную температуру 79,9 °C и опускалась до 0 °C по мере таяния льда (и оставалась при 0 °C все время).
Задача №16: В реальных калориметрах большая часть тепла, выделяемого бомбой, поглощается водой, но некоторое количество тепла также поглощается металлом и изоляцией, окружающими резервуар для воды. Некоторый калориметр поглощает 24 Дж/°С. Если 50,0 г воды с температурой 52,7 °C смешать с исходными 50,0 г воды с температурой 22,3 °C из калориметра, какой будет конечная температура смеси?
Решение:
1) У нас есть немного теплой воды, которая теряет тепло. Мы можем настроить расчет для определения суммы:
(50,0 г) (4,184 Дж/г °C) (52,7 °C − T)T — конечная температура, а (52,7 °C − T) — изменение температуры.
2) Все потерянное тепло уходит в два места:
(а) прохладная вода
(b) сам калориметр3) Вот установка для (а):
(50,0 г) (4,184 Дж/г °С) (Т — 22,3 °С)Помните, что T (конечная температура) выше 22,3 °C, поэтому изменение температуры начинается с 22,3 °C и достигает T.
4) Вот установка для (b):
(24 Дж/°С) (Т — 22,3°С)Калориметр имеет ту же начальную температуру (22,3 °C), что и холодная вода, и заканчивается при той же температуре T (конечная температура), поэтому он подвергается такому же изменению температуры (называемому ΔT)
5) Теперь составим уравнение. . . :
(50,0 г) (4,184 Дж/г °C) (52,7 − T) = (50,0 г) (4,184 Дж/г °C) (T − 22,3) + (24 Дж/°C) (T − 22,3)Левая сторона – это тепло, выходящее из теплой воды, а правая сторона – это тепло, поступающее в два места назначения (сам калориметр и холодная вода).
6) . . . и решить это:
(50,0) (4,184) (52,7 — Т) = (50,0) (4,184) (Т — 22,3) + (24) (Т — 22,3)11024,84 − 209,2T = (209,2T − 4665,16) + (24T − 535,2)
11024,84 − 209,2T = 233,2T − 5200,36
442,4Т = 16225,2
T = 36,7 °C (до трех знаков цифры)
Задача №17: 40,0 г льда при температуре 0,0 °C смешивают со 150,0 г жидкой воды при температуре 80,0 °C в калориметре кофейной чашки.
Рассчитайте достигнутую конечную температуру, предполагая отсутствие потери или поступления тепла из окружающей среды.
Обсуждение:
Мы знаем, что температура жидкой воды упадет, возможно, до нуля. Мы также знаем, что часть (если не весь) лед растает. Я собираюсь посмотреть, сколько энергии требуется, чтобы растопить весь лед, а затем посмотреть, как это соотносится с энергией, выделяемой при охлаждении жидкой воды.Решение:
1) Сколько энергии потребуется, чтобы растопить весь лед:
(40,0 г / 18,015 г/моль) (6,02 кДж/моль) = 13,367 кДж = 13 367 Дж2) Сколько энергии выделится жидкой водой при охлаждении до нуля градусов Цельсия:
q = (масса) (Δt) (удельная теплоёмкость)q = (150 г) (80,0 °С) (4,184 Дж/г °С)
q = 50208 Дж
Этот расчет показывает, что энергии достаточно, чтобы растопить весь лед. Иногда учитель будет давать вам задачу, где не весь лед растает за счет энергии теплой воды.
В этом случае конечная температура будет равна нулю по Цельсию. См. пример ниже.
3) Нам нужно знать, на сколько изменится температура, если из теплой воды будет удалено 13 367 Дж энергии.
q = (масса) (Δt) (удельная теплоёмкость)13367 Дж = (150, г) (Δt) (4,184 Дж/г °С)
Δt = 21,2986 °C (конечную температуру я округлю до трех цифр)
4) Теперь у нас есть новая задача: «Какова конечная температура, когда 40,0 г воды при 0,00 °С смешивают со 150,0 г воды при 58,7014 °С».
(40,0 г) (x − 0 °C) (4,184 Дж/г °C) = (150, г) (58,7014 °C − x) (4,184 Дж/г °C)(40,0 г) (x — 0 ° C) = (150, г) (58,7014 ° C — x)
40х = 8805,21 — 150х
190x = 8805,21
х = 46,3 °С
Задача №18: 40,0 г льда при 0,0 °C смешивают со 150 г жидкой воды при 20,0 °C в калориметре кофейной чашки. Рассчитайте достигнутую конечную температуру, предполагая отсутствие потери или поступления тепла из окружающей среды.
Решение:
1) Сколько энергии потребуется, чтобы растопить весь лед:
(40,0 г / 18,015 г/моль) (6,02 кДж/моль) = 13,367 кДж = 13 367 Дж2) Сколько энергии выделится жидкой водой при охлаждении до нуля градусов Цельсия:
q = (масса) (Δt) (удельная теплоёмкость)q = (150 г) (20,0 °С) (4,184 Дж/г °С)
q = 12 552 Дж
3) Немного обсуждения:
Этот расчет показывает, что энергии недостаточно, чтобы растопить весь лед. Это означает, что конечная температура равна нулю по Цельсию, а в жидкой воде плавает некоторое количество нерастаявшего льда.В этот момент задача может спросить, сколько льда осталось нерасплавленным. Ответ для приведенной выше задачи равен 2,44 г. Я оставлю вас подумать, как это понять.
Задача №18: Равные массы жидкости А при начальной температуре 100°С и жидкости В при начальной температуре 50°С смешивают в изолированном контейнере.
Конечная температура смеси составляет 80°С. Что имеет большую удельную теплоемкость, А или В?
Решение:
1) Предположим, что:
Тепло, выделяемое А, равно теплу, поглощаемому В. Тепло не теряется с контейнером.2) В уравнении запишем так:
А = В3) Это, следовательно, также верно:
(масса A) (изменение температуры A) (sp теплота A) = (масса B) (изменение температуры B) (sp теплота B)4) Массы равны, что дает:
(температурное изменение A) (sp теплота A) = (температурное изменение B) (sp теплота B)5) Замена:
(20) (А) = (30) (Б)А = 1,5 В
Удельная теплоемкость A больше, чем у B.
Бонусная задача: Вода с температурой 0 °C была помещена в тарелку внутри сосуда, поддерживающего низкое давление с помощью вакуумного насоса. После того, как некоторое количество воды испарилось, напоминание замерло.
Если было получено 9,31 г льда при 0 °С, сколько жидкой воды должно было испариться? (При 0 °C ΔH сплав = 6,02 кДж/моль; ΔH пар = 45,054 кДж/моль)
Решение:
1) Замерзшая вода (9,31 г) выделила:
(9,31 г) (6,02 кДж/моль) (1 моль/18,015 г) = 3,11108 кДж2) Эта энергия выделяется при испарении воды:
энергия = (моли испарившейся воды) (теплота парообразования)3,1108 кДж = (масса испаряемой воды) (45,054 кДж/моль)
0,069046 моль испарившейся воды
(0,069046 моль) (18,015 г/моль) = 1,24 г (до трех цифр)
Обратите внимание на использование ΔH vap для 0 °C. При 100 °С она равна 40,7 кДж/моль. (Вот источник, который я использовал для значения 45,054.)
Перейти к разделу Смешивание двух количеств воды
Рабочий лист №2
Назад в меню термохимии
ChemTeam: как определить удельную теплоемкость: задача 1
ChemTeam: Как определить удельную теплоемкость: задача 1–10Как определить удельную теплоемкость вещества
Задачи #1 — 10
Перейти к учебнику по удельной теплоемкости
Вернуться в меню термохимии
Задача №1: Предположим, что кусок железа массой 21,5 г при температуре 100,0 °C брошен в изолированный сосуд с водой. Масса воды 132,0 г, ее температура перед добавлением железа 20,0 °С. Какой будет конечная температура системы? Удельная теплоемкость железа 0,449 кДж/кг К.
Масса воды 132,0 г, ее температура перед добавлением железа 20,0 °С. Какой будет конечная температура системы? Удельная теплоемкость железа 0,449 кДж/кг К.
Решение:
1) С
q потерянный, металлический = q получено, вода
пишем
(масса) (Δt) (C p, металл ) = (масса) (Δt) (C p, вода )
2) Замена:
(21,5) (100 — х) (0,449) = (132,0) (х — 20) (4,184)
Некоторые пояснения:
а) 100 − x – Δt для металла; она начинается при 100,0 °C и падает до неизвестного конечного значения.
б) x − 20 – Δt для воды; она начинается при 20,0 °C и поднимается до какого-то неизвестного конечного значения.
c) Поскольку и металл, и вода имеют одно и то же конечное значение, нам нужно использовать только одно неизвестное для двух выражений Δt.
3) Немного алгебры:
(2150 − 21,5x) (0,449) = (132x − 2640) (4,184)965,35 — 9,6535 х = 552,288 х — 11045,76
561,9415x = 12011,11
На 3 знака инжира ответ равен 21,4 °C.
Задача № 2: Образец неизвестного металла весом 12,48 г, нагретый до 99,0 °C, затем погрузили в 50,0 мл воды с температурой 25,0 °C. Температура воды поднялась до 28,1°С. Предполагая отсутствие потерь энергии в окружающую среду:
1. Сколько джоулей энергии поглотила вода?
2. Сколько джоулей энергии потерял металл?
3. Какова теплоемкость металла?
4. Что такое удельная теплоемкость металла?
Решение:
1) q = (50,0 г) (3,1 °С) (4,184 Дж г¯ 1 °С¯ 1 ) = 648,52 Дж2) 648,52 Дж
3) 648,52 Дж / 70,9 °С = 9,147 Дж/°С
4) 9,147 Дж/°C разделить на 12,48 г = 0,733 Дж г¯ 1 °C¯ 1
Комментарий №1: в этом вопросе не используется q потерял = q приобрел постановку других вопросов. Это потому, что вопрос разбит на четыре части. Обратите внимание, что части (1) и (2) эквивалентны q потерянных = q полученных и что (4) является обычным ответом, который ищут в задачах этого типа.
Комментарий №2: (3) — шаг, ненужный для решения (4). Именно там вы заметите разницу между теплоемкостью и удельной теплоемкостью.
Задача №3: Блок неизвестного металла массой 43,2 г при температуре 89,0 °С бросили в изотермический сосуд, содержащий 43,00 г льда и 26,00 г воды при 0 °С. После того, как система достигла равновесия, было определено, что 9,15 г льда растаяли. Чему равна удельная теплоемкость металла? (Теплота плавления льда = 334,166 Дж/г¯ 1 .)
Решение:
Комментарий: этот вариант обычных подозреваемых (подробно описанных выше) НЕ включает изменение температуры воды, только металла. Скорее, часть льда тает, и вся система лед-вода остается при нуле по Цельсию. Очень интересно!
1) Определить количество теплоты, полученное таявшим льдом:
9,15 г умножить на 334,166 Дж г¯ 1 = 3057,62 Дж
2) Подставьте и решите удельную теплоемкость:
q = (масса) (Δt) (C p, металл )3057,62 Дж = (43,2 г) (89,0 °С) (х)
x = 0,795 Дж г¯ 1 °C¯ 1
Задача № 4: Блок металла массой 35,0 г при температуре 80,0 °C добавляют к смеси 100,0 г воды и 15,0 г льда в изолированном контейнере. Весь лед растаял, и температура в контейнере поднялась до 10,0 °С. Чему равна удельная теплоемкость металла?
Весь лед растаял, и температура в контейнере поднялась до 10,0 °С. Чему равна удельная теплоемкость металла?
Решение:
1) Определить теплоту, необходимую для растапливания льда:
q = (15,0 г) (334,166 Дж g¯ 1 ) = 5012,49 ДжОбратите внимание, что 100 г воды еще не упоминаются.
2) Определить количество тепла, необходимое для нагревания 115 г воды от 0 до 10,0 °С:
q = (115 г) (10,0 °C) (4,184 Дж g¯ 1 °C¯ 1 ) = 4811,6 ДжОбратите внимание на растаявшие 15 г льда. Также обратите внимание, что температура воды была нулевой °C. Мы знаем это по наличию льда.
3) Определить удельную теплоемкость металла:
(5012,49 Дж + 4811,6 Дж) = (35,0 г) (70,0 °С) (х)x = 4,01 Дж г¯ 1 °C¯ 1
Задача № 5: Образец элемента весом 500,0 г при температуре 153,0 °C падает в смесь льда и воды. 109,5 г льда растаяли и осталась смесь лед-вода. Чему равна удельная теплоемкость металла в Дж/г-°С? Учитывая молярную теплоемкость металла 26,31 Дж/моль°C, каковы атомный вес и идентичность металла?
109,5 г льда растаяли и осталась смесь лед-вода. Чему равна удельная теплоемкость металла в Дж/г-°С? Учитывая молярную теплоемкость металла 26,31 Дж/моль°C, каковы атомный вес и идентичность металла?
Решение:
1) Определить энергию, необходимую для таяния льда:
(6,02 кДж/моль) (109,5 г / 18,015 г/моль) = 36,5912 кДж
2) Определить удельную теплоемкость:
36591,2 Дж = (500,0 г) (153,0 °С) (х)х = 0,4783 Дж/г-°C
Примечание: мы знаем, что изменение температуры составляет 153,0 °C, потому что в воде все еще есть лед. Это означает, что смесь льда и воды оставалась при нуле по Цельсию, когда растаяли 109,5 г льда.
3) Определить атомную массу элемента:
(0,4783 Дж/г °С) (x) = 26,31 Дж/моль °Сх = 55,0 г/моль
Элемент марганец.
Задача № 6: Образец неизвестного металла весом 12,48 г нагревают до 99,0 °C, а затем погружают в 50,0 мл воды с температурой 25,0 °C. Температура воды поднялась до 28,1°С.
Температура воды поднялась до 28,1°С.
а) Сколько джоулей энергии поглотила вода?
б) Сколько джоулей энергии потерял металл?
в) Какова теплоемкость металла?
(d) Какова удельная теплоемкость металла?
Определения теплоемкости и удельной теплоемкости можно найти здесь.
1) Решение (а):
q = (50,0 г) (3,1 °С) (4,181 Дж г¯ 1 °С¯ 1 ) = 648,52 Дж
Я использовал 50,0 г, потому что плотность воды составляет 1,00 г/мл, а у меня было 50,0 мл воды.
2) Решение (б):
q = 648,52 Дж
Мы предполагаем, что все тепло, поглощенное водой, было потеряно металлом. Предполагается отсутствие потерь тепловой энергии наружу при передаче.
3) Решение (с):
648,52 Дж / 74,0 °C = 8,76 Дж/°C (или 8,76 Дж/К)
4) Решение (г):
(50,0 г) (3,1 °C) (4,181 Дж г¯ 1 °C¯ 1 ) = (12,48 г) (74,0 °C) (x)Найдите x.
Задача № 7: Какова удельная теплоемкость металла, если прибавление 90,0 г металла при 17,7 °С к 210,0 г меди (s = 0,385 Дж/г-°С) при 153,7 °С дает смеси, достигающей теплового равновесия при 129,1 °С?
Решение:
Комментарий: обратите внимание, что два металла добавляются друг к другу. Представьте себе ситуацию, когда каждый образец состоит из пыли или очень мелких гранул. Затем два сухих образца быстро перемешивают.(90,0 г) (111,4 °C) (x) = (210,0 г) (24,6 °C) (0,385 Дж/г-°C)
х = 0,198 Дж/г-°C
Задача № 8: Блок неизвестного металла массой 31,0 грамм при температуре 88,0 °C был брошен в изолированную колбу, содержащую примерно 30,0 граммов льда и 20,0 граммов воды при 0,0 °C. После того, как система достигла постоянной температуры, было определено, что 12,1 грамма льда растаяли. Чему равна удельная теплоемкость металла? Теплота плавления льда равна 334,166 Дж/г.
Решение:
12,0 г умножить на 334,166 Дж/г = 4009,992 Дж4009,992 Дж = (31,0 г) (88,0 °С) (х)
х = 1,47 Дж/г °С
Комментарий: тот факт, что лед остался в воде, когда температура достигла равновесия, означает, что смесь воды и льда оставалась при нуле по Цельсию. Это означает, что металл перешел от 88,0 ° C к 0 ° C для Δt 88,0 ° C.
Задача № 9: Образец метанола весом 25,95 г при температуре 35,60 °C добавляют к образцу этанола весом 38,65 г при температуре 24,70 °C в калориметре постоянного давления. Если конечная температура объединенных жидкостей 28,65 °С, а теплоемкость калориметра 19.3 Дж/Кл, определите удельную теплоемкость метанола.
Решение:
тепло, теряемое метанолом, идет на (1) нагрев этанола и (2) нагрев калориметра(25,95 г) (6,95 °C) (x) = (38,65 г) (3,95 °C) (2,44 Дж г -1 °C -1 ) + (3,95 °C) (19,3 Дж/Кл)
х = 2,49 Дж г -1 °С -1
Задача №10: Учащийся нагревает 130 г неизвестного сероватого металла до темп.

 Яка маса Місяця? 2б.
8. Космічний корабель масою 8 т наближається до орбітальної станції масою 20 т на відстань 100 м. Знайдіть
силу їх взаємного притягання.
Яка маса Місяця? 2б.
8. Космічний корабель масою 8 т наближається до орбітальної станції масою 20 т на відстань 100 м. Знайдіть
силу їх взаємного притягання.




