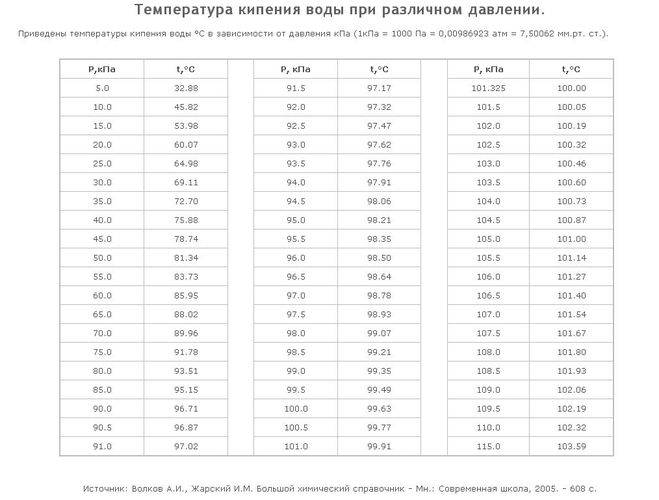
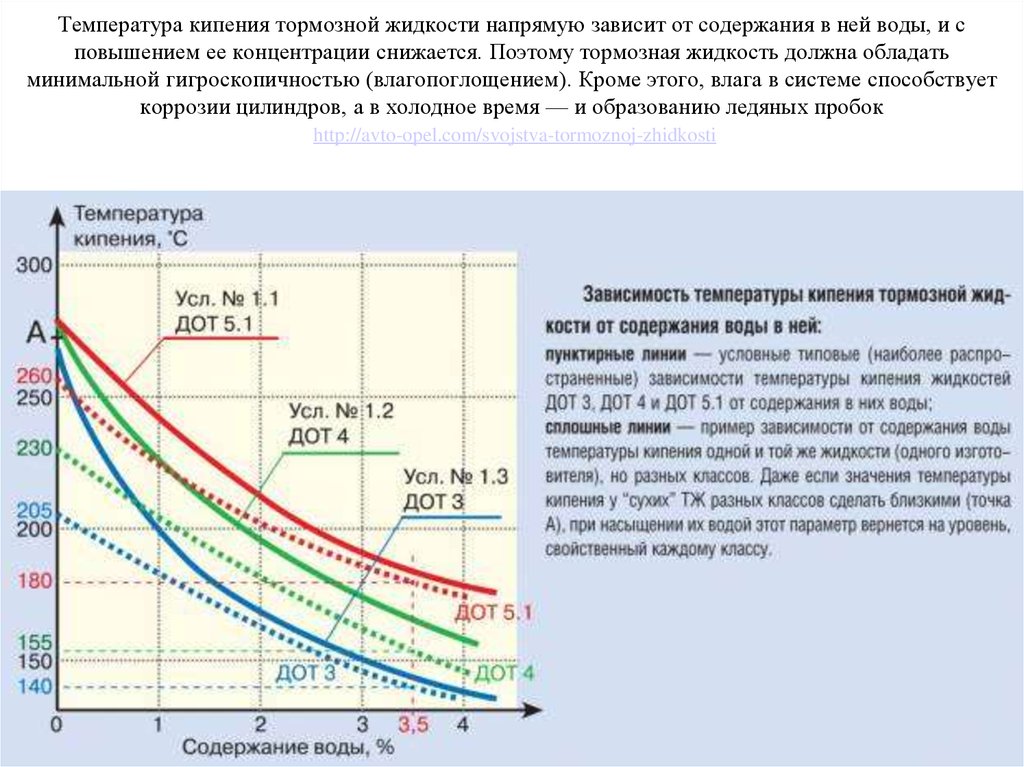
Температура кипения воды в зависимости от давления
02.12.2016
Схема зависимости температуры пара от давления
| Давление, атм. | Температура, oС |
| 0,01 | 6,70 oС |
| 0,02 | 17,20 oС |
| 0,04 | 28,64 oС |
| 0,1 | 45,45 oС |
| 0,2 | 59,67 oС |
| 0,3 | 68,68 oС |
| 0,4 | 75,42 oС |
| 0,5 | 80,86 oС |
| 0,6 | 85,45 oС |
| 0,7 | 89,45 oС |
| 0,8 | 92,99 oС |
| 0,9 | 96,18 o |
| 1,0 | 99,09 oС |
| 1,033 | 100,00 oС |
| 1,5 | 110,79 oС |
| 2,0 | 119,62 oС |
| 2,5 | 126,79 oС |
| 3,0 | 132,88 oС |
| 4,0 | 142,92 oС |
| 5,0 | 151,11 oС |
| 6,0 | 158,08 oС |
| 7,0 | 164,17 oС |
| 8,0 | 169,61 oС |
| 9,0 | 174,53 oС |
| 10 | 179,04 oС |
| 20 | 211,38 oС |
| 25 | 222,90 o С |
| 50 | 262,70 oС |
| 100 | 309,53 oС |
Выбор сечения провода в зависимости от тока
03. 12.2016
12.2016
Для нормальной работы парогенератора важно выбрать силовой кабель нужного сечения. В этой статье приведены таблицы, которые взяты из нормативного документа «Правила устройства электроустанов…
Подробнее
Газовое пожаротушение
19.12.2016
Газовое пожаротушение — один из множества способов борьбы с огнем, при котором применяются сжатые газы (например, азот и аргон) и хладоны. Основное преимущество газового пожаротушения перед водяным, а…
Подробнее
Жесткость воды — один из главных показателей для парогенераторов
С точки зрения эксплуатации парогенерирующего оборудования жесткость воды, а также общая минерализация и содержание в ней железа являются главными параметрами, с которым необходимо считаться. В данной…
В данной…
Подробнее
Зависимость температуры кипения от давления. Движение. Теплота
Зависимость температуры кипения от давления
Температура кипения воды равна 100 °C; можно подумать, что это неотъемлемое свойство воды, что вода, где бы и в каких условиях она ни находилась, всегда будет кипеть при 100 °C.
Но это не так, и об этом прекрасно осведомлены жители высокогорных селений.
Вблизи вершины Эльбруса имеется домик для туристов и научная станция. Новички иногда удивляются, «как трудно сварить яйцо в кипятке» или «почему кипяток не обжигает». В этих случаях им указывают, что вода кипит на вершине Эльбруса уже при 82 °C.
В чем же тут дело? Какой физический фактор вмешивается в явление кипения? Какое значение имеет высота над уровнем моря?
Этим физическим фактором является давление, действующее на поверхность жидкости. Не нужно забираться на вершину горы, чтобы проверить справедливость сказанного.
Помещая подогреваемую воду под колокол и накачивая или выкачивая оттуда воздух, можно убедиться, что температура кипения растет при возрастании давления и падает при его уменьшении.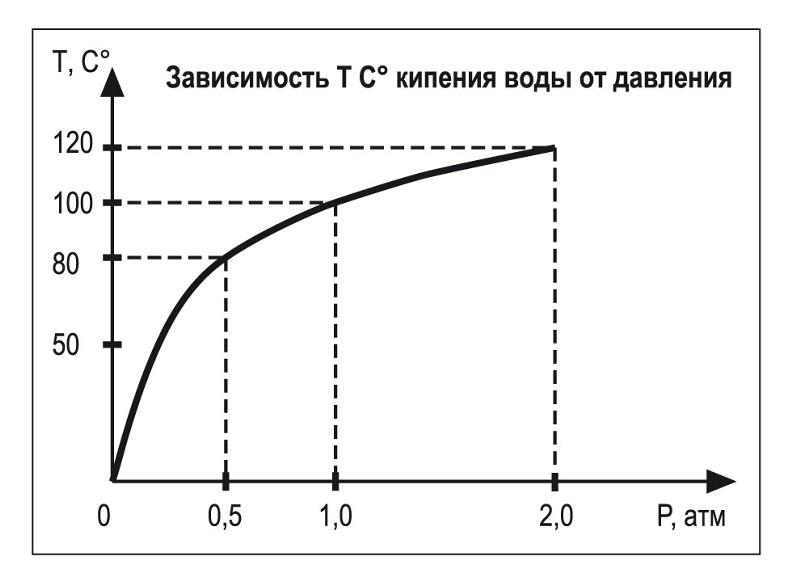
Вода кипит при 100 °C только при определенном давлении – 760 мм Hg.
Кривая температуры кипения в зависимости от давления показана на рис. 98. На вершине Эльбруса давление равно 0,5 атм, этому давлению и соответствует температура кипения 82 °C.
А вот водой, кипящей при 10–15 мм Нg, можно освежиться в жаркую погоду. При этом давлении температура кипения упадет до 10–15 °C.
Можно получить даже «кипяток», имеющий температуру замерзающей воды. Для этого придется снизить давление до 4,6 мм Hg.
Интересную картину можно наблюдать, если поместить открытый сосуд с водой под колокол и откачивать воздух. Откачка заставит воду закипеть, но кипение требует тепла. Взять его неоткуда, и воде придется отдать свою энергию. Температура кипящей воды начнет падать, но так как откачка продолжается, то падает и давление. Поэтому кипение не прекратится, вода будет продолжать охлаждаться и в конце концов замерзнет.
Такое кипение холодной воды происходит не только при откачке воздуха. Например, при вращении гребного корабельного винта давление в быстро движущемся около металлической поверхности слое воды сильно падает и вода в этом слое закипает, т.е. в ней появляются многочисленные наполненные паром пузырьки. Это явление называется кавитацией (от латинского слова cavitas – полость).
Например, при вращении гребного корабельного винта давление в быстро движущемся около металлической поверхности слое воды сильно падает и вода в этом слое закипает, т.е. в ней появляются многочисленные наполненные паром пузырьки. Это явление называется кавитацией (от латинского слова cavitas – полость).
Снижая давление, мы понижаем температуру кипения. А увеличивая его? График, подобный нашему, отвечает на этот вопрос. Давление в 15 атм может задержать кипение воды, оно начнется только при 200 °C, а давление в 80 атм заставит воду закипеть лишь при 300 °C.
Итак, определенному внешнему давлению соответствует определенная температура кипения. Но это утверждение можно и «перевернуть», сказав так: каждой температуре кипения воды соответствует свое определенное давление. Это давление называется упругостью пара.
Кривая, изображающая температуру кипения в зависимости от давления, является одновременно и кривой упругости пара в зависимости от температуры.
Цифры, нанесенные на график температуры кипения (или на график упругости пара), показывают, что упругость пара меняется очень резко с изменением температуры.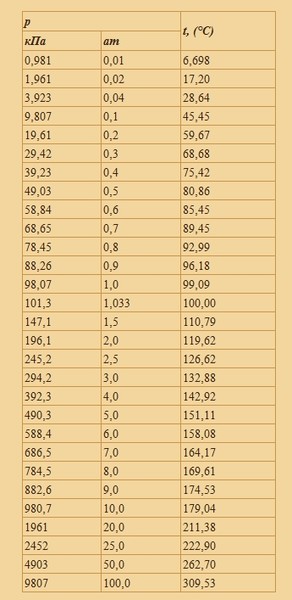
Поэтому, напротив, температура кипения меняется с давлением довольно медленно. При изменении давления вдвое – от 0,5 атм до 1 атм, температура кипения возрастает от 82 °C (т.е. 355 K) до 100 °C (т.е. 373 K) и при изменении вдвое от 1 атм до 2 атм – от 100 °C (т.е. 373 K) до 120 °C (т.е. 393 K).
Та же кривая, которую мы сейчас рассматриваем, управляет и конденсацией (сгущением) пара в воду.
Превратить пар в воду можно либо сжатием, либо охлаждением.
Как во время кипения, так и в процессе конденсации точка не сдвинется с кривой, пока превращение пара в воду или воды в пар не закончится полностью. Это можно сформулировать еще и так: в условиях нашей кривой и только при этих условиях возможно сосуществование жидкости и пара.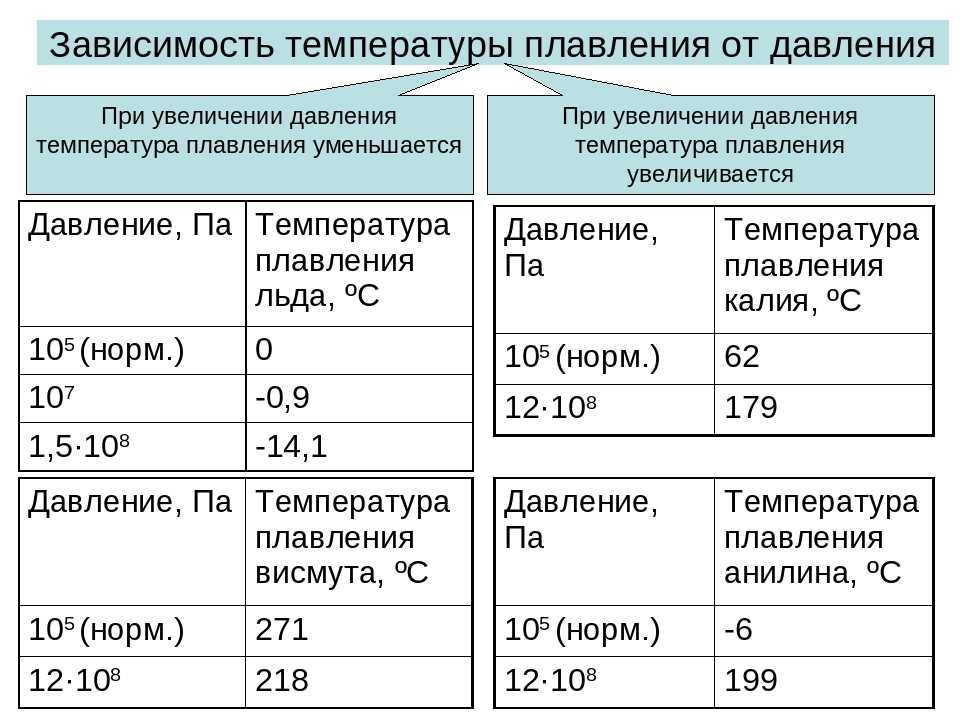
Кривая кипения и конденсации имеет, как мы видим, еще один смысл – это кривая равновесия жидкости и пара. Кривая равновесия делит поле диаграммы на две части. Влево и вверх (к большим температурам и меньшим давлениям) расположена область устойчивого состояния пара. Вправо и вниз – область устойчивого состояния жидкости.
Кривая равновесия пар – жидкость, т.е. кривая зависимости температуры кипения от давления или, что то же самое, упругости пара от температуры, примерно одинакова для всех жидкостей. В одних случаях изменение может быть несколько более резким, в других – несколько более медленным, но всегда упругость пара быстро растет с увеличением температуры.
Уже много раз мы пользовались словами «газ» и «пар».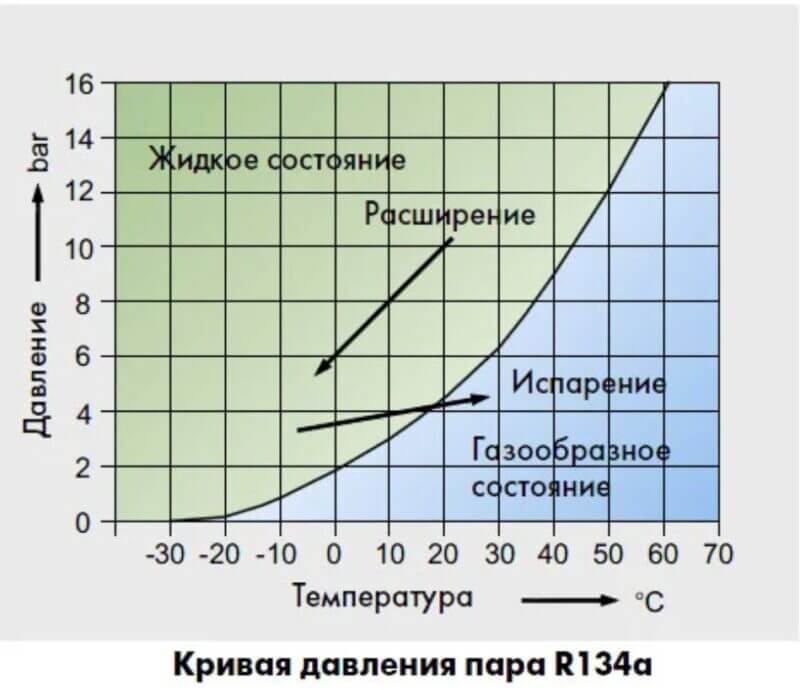 Эти два слова довольно равноправны. Можно сказать: водяной газ есть пар воды, газ кислород есть пар кислородной жидкости. Все же при пользовании этими двумя словами сложилась некоторая привычка. Так как мы привыкли к определенному относительно небольшому интервалу температур, то слово «газ» мы применяем обычно к тем веществам, упругость пара которых при обычных температурах выше атмосферного давления. Напротив, о паре мы говорим тогда, когда при комнатной температуре и давлении атмосферы вещество более устойчиво в виде жидкости.
Эти два слова довольно равноправны. Можно сказать: водяной газ есть пар воды, газ кислород есть пар кислородной жидкости. Все же при пользовании этими двумя словами сложилась некоторая привычка. Так как мы привыкли к определенному относительно небольшому интервалу температур, то слово «газ» мы применяем обычно к тем веществам, упругость пара которых при обычных температурах выше атмосферного давления. Напротив, о паре мы говорим тогда, когда при комнатной температуре и давлении атмосферы вещество более устойчиво в виде жидкости.
К квантовой теории абсолютного нуля температуры
К квантовой теории абсолютного нуля температуры Ниже помещен перевод заметки» написанной известными физиками и опубликованной в «Natur-wissenschaften». Редакторы журнала «попались на удочку громких имен» и, не вдаваясь в существо написанного, направили полученный материал в6.
 Математическая статистика и корреляционная зависимость
Математическая статистика и корреляционная зависимость6. Математическая статистика и корреляционная зависимость Математическая статистика – наука о математических методах систематизации и использования статистических данных для решения научных и практических задач. Математическая статистика тесно примыкает к теории
К квантовой теории абсолютного нуля температуры
К квантовой теории абсолютного нуля температуры Д. Бак, Г. Бете, В. Рицлер (Кембридж) «К квантовой теории абсолютного нуля температуры» и заметки, переводы которых помещены ниже: К квантовой теории абсолютного нуля температуры Движение нижней челюсти у крупного
Изменение давления с высотой
Изменение давления с высотой
С изменением высоты давление падает. Впервые это было выяснено французом Перье по поручению Паскаля в 1648 г. Гора Пью де Дом, около которой жил Перье, была высотой 975 м. Измерения показали, что ртуть в торричеллиевой трубке падает при подъеме на
Гора Пью де Дом, около которой жил Перье, была высотой 975 м. Измерения показали, что ртуть в торричеллиевой трубке падает при подъеме на
Влияние давления на температуру плавления
Влияние давления на температуру плавления Если изменить давление, то изменится и температура плавления. С такой же закономерностью мы встречались, когда говорили о кипении. Чем больше давление, тем выше температура кипения. Как правило, это верно и для плавления. Однако
Температура кипения воды при более высоком давлении
Когда вода нагревается, она достигает температуры — точки кипения — при которой давление пара становится достаточно большим, чтобы внутри воды образовывались пузырьки. Температура кипения воды зависит от давления.
Онлайн-калькулятор температуры кипения воды
Приведенный ниже калькулятор можно использовать для расчета температуры кипения воды при заданном абсолютном давлении.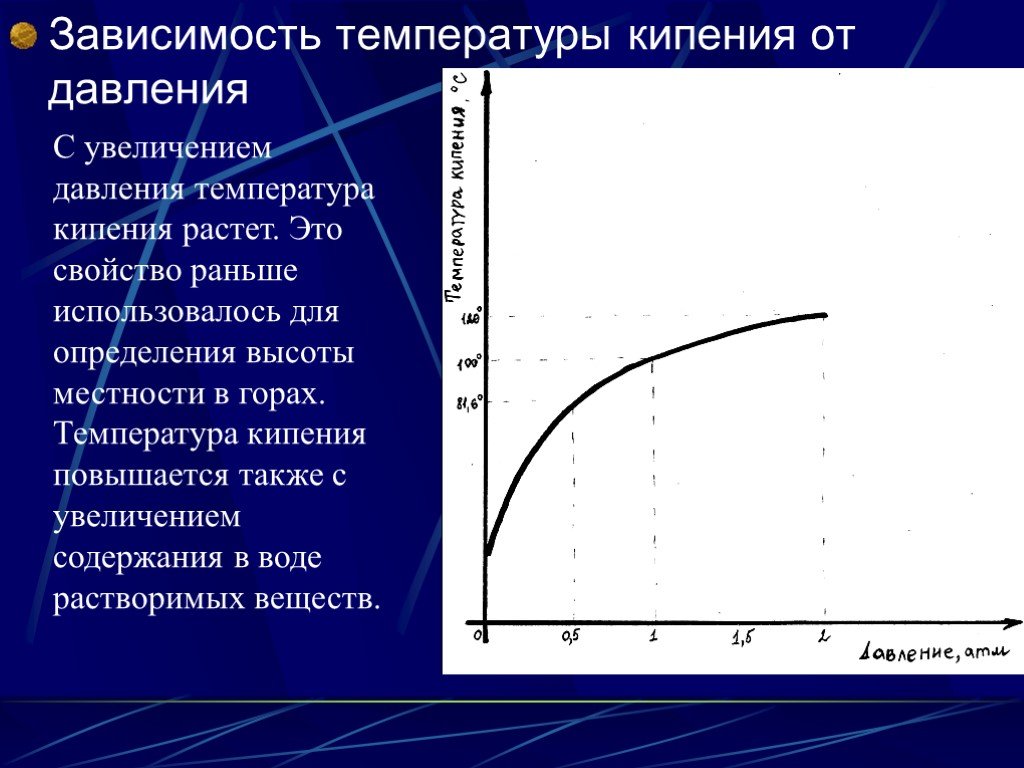
Температура на выходе указывается в °C, °F, K и °R.
Внимание! Давление должно быть в пределах 1-220 бар абс., 14,7-3200 фунтов на кв. дюйм, 760-165 000 мм рт. ст. или 30-6500 дюймов рт. ст.
Температуры кипения воды при абсолютном давлении в диапазоне от 1 до 70 бар абс. или от 14,7 до 1000 фунтов на кв. дюйм указаны на рисунках и в таблицах ниже:
Термодинамические свойства при стандартных условиях см. в разделе «Вода и тяжелая вода».
См. также другие свойства Вода при различной температуре и давлении : Температуры кипения при вакуумном давлении, Плотность и удельный вес, Динамическая и кинематическая вязкость, Энтальпия и энтропия, Теплота парообразования, Константа ионизации, pK w , нормальной и тяжелой воды, температуры плавления при высоком давлении, число Прандтля, свойства в условиях газожидкостного равновесия, давление насыщения, удельный вес, удельная теплоемкость (теплоемкость), удельный объем, теплопроводность, температуропроводность и пар давление при газожидкостном равновесии.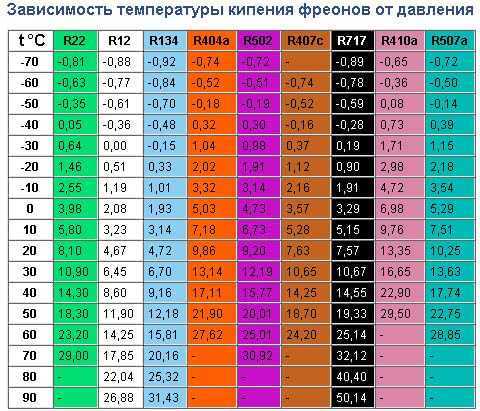
| Абсолютное давление | Температура кипения воды 9 0040 | ||||
| [бар абс.] [1×10 5 *Па] | [пси] | [мм рт.ст.] | 900 47 [в рт.ст.][°C] | [°F] | |
| 1,013 | 14,7 | 760 | 29,92 | 100 90 040 | 212 |
| 1,034 | 15,0 | 776 | 30,54 | 101 | 213 |
| 1,103 | 16,0 | 827 | 32,58 | 102 | 216 | 900 45
| 1,172 | 17,0 | 879 | 34,61 | 104 | 219 |
| 18,0 | 931 | 36,65 | 106 | 222 | |
| 1,310 | 19,0 | 983 9004 0 | 38,68 | 107 | 225 |
| 1,379 | 20,0 | 1034 | 40,72 | 109 | 228 | 90 045
| 1,517 | 22,0 | 1138 | 44,79 | 112 | 233 |
| 1,655 | 24,0 | 1241 | 48,86 | 114 | 238 |
| 1,793 | 26,0 | 1345 90 040 | 52,94 | 117 | 242 |
| 1,931 | 28,0 | 1448 | 57,01 | 119 | 24 6 |
| 2,068 | 30,0 | 1551 | 61,08 | 121 | 250 | 9 0045
| 2,206 | 32,0 | 1655 | 65,15 | 123 | 254 |
| 2,344 | 34,0 | 9 0047 175869,22 | 125 | 258 | |
| 2,482 | 36,0 | 1862 | 73,30 | 127 | 90 047 261|
| 2,620 | 38,0 | 1965 | 77,37 | 129 | 264 9 0040 |
| 2,758 | 40,0 | 2069 | 81,44 | 131 | 267 |
| 2,896 | 42,0 90 040 | 2172 | 85,51 | 132 | 270 |
| 3,034 | 44,0 | 2275 | 89,58 | 13 4 | 273 |
| 3,172 | 46,0 | 2379 | 93,66 | 135 | 9 0047 276|
| 3,309 | 48,0 | 2482 | 97,73 | 137 | 279 |
| 3,447 | 9 0047 50,02586 | 101,8 | 138 | 281 | |
| 3,585 | 52,0 | 2689 | 105,9 | 90 047 140284 | |
| 3,723 | 54,0 | 2793 | 109,9 | 141 9 0040 | 286 |
| 3,861 | 56,0 | 2896 | 114,0 | 142 | 288 |
| 3,999 9 0040 | 58,0 | 2999 | 118,1 | 144 | 291 |
| 4,137 | 60,0 | 3103 | 122,2 | 90 047 145293 | |
| 4,275 | 62,0 | 3206 | 126,2 | 146 9 0040 | 295 |
| 4,413 | 64,0 | 3310 | 130,3 | 147 | 297 |
| 4,551 9 0040 | 66,0 | 3413 | 134,4 | 148 | 299 |
| 4,688 | 68,0 | 3517 | 138,4 | 90 047 149301 | |
| 4,826 | 70,0 | 3620 | 142,5 | 151 9 0040 | 303 |
| 4,964 | 72,0 | 3723 | 146,6 | 152 | 305 |
| 5,102 9 0040 | 74,0 | 3827 | 150,7 | 153 | 307 |
| 5,240 | 76,0 | 3930 | 154,7 | 90 047 154309 | |
| 5,378 | 78,0 | 4034 | 158,8 | 155 9 0040 | 310 |
| 5,516 | 80,0 | 4137 | 162,9 | 156 | 312 |
| 5,654 9 0040 | 82,0 | 4241 | 167,0 | 157 | 314 |
| 5,792 | 84,0 | 4344 | 171,0 | 90 047 158316 | |
| 5,929 | 86,0 | 4447 | 175,1 | 158 9 0040 | 317 |
| 6,067 | 88,0 | 4551 | 179,2 | 159 | 319 |
| 6,205 9 0040 | 90,0 | 4654 | 183,2 | 160 | 320 |
| 6,343 | 92,0 | 4758 | 187,3 | 90 047 161322 | |
| 6,481 | 94,0 | 4861 | 191,4 | 162 9 0040 | 323 |
| 6,619 | 96,0 | 4965 | 195,5 | 163 | 325 |
| 6,757 9 0040 | 98,0 | 5068 | 199,5 | 164 | 326 |
| 6,895 | 100 | 5171 | 203,6 9004 0 | 164 | 328 |
| 7,239 | 105 | 5430 | 213,8 | 16 6 | 331 |
| 7,584 | 110 | 5689 | 224,0 | 168 | 335 |
7. 929 929 | 115 | 5947 | 234.1 | 170 | 338 |
| 8.274 | 120 | 6206 | 244 .3 | 172 | 341 |
| 10,34 | 150 | 7757 | 305,4 | 9 0047 181359 | |
| 12,07 | 175 | 9050 | 356,3 | 189 | 372 |
| 200 | 10343 | 407,2 | 194 | 382 | |
| 15,51 | 225 | 11636 | 90 047 458,1200 | 392 | |
| 17,24 | 250 | 12929 | 509,0 | 205 | 401 |
| 18,96 | 275 | 14222 | 559,9 | 210 | 410 | 20,68 | 300 | 15514 | 610,8 | 214 | 417 |
| 22,41 | 325 | 16807 | 90 047 661,7218 | 425 | |
| 24,13 | 350 | 18100 | 712,6 | 222 | 432 |
| 25,86 | 375 | 19393 | 763,5 | 226 | 438 | 27,58 | 400 | 20686 | 814,4 | 229 | 445 |
| 29,30 | 425 | 21979 | 90 047 865,3233 | 451 | |
| 31,03 | 450 | 23272 | 916,2 | 236 | 456 |
| 32,75 | 475 | 24565 | 967,1 | 239 | 462 | 34,47 | 500 | 25857 | 1018 | 242 | 467 |
| 36,20 | 525 | 27150 | 900 47 1069245 | 472 | |
| 37,92 | 550 | 28443 | 1120 90 040 | 247 | 477 |
| 39,64 | 575 | 29736 | 1171 | 250 | 482 | 41,37 | 600 | 31029 | 1222 | 252 | 486 |
| 43,09 | 625 | 32322 | 90 047 1273255 | 491 | |
| 44,82 | 650 | 33615 | 1323 9 0040 | 257 | 495 |
| 46,54 | 675 | 34908 | 1374 | 260 | 499 | 48. 26 26 | 700 | 36200 | 1425 | 262 | 503 |
| 49,99 | 725 | 37493 | 900 47 1476264 | 507 | |
| 51,71 | 750 | 38786 | 1527 90 040 | 266 | 511 |
| 53,43 | 775 | 40079 | 1578 | 268 | 515 | 55.16 | 800 | 41372 | 1629 | 270 | 518 |
| 56,88 | 825 | 42665 | 900 47 1680272 | 522 | |
| 58,61 | 850 | 43958 | 1731 90 040 | 274 | 525 |
| 60,33 | 875 | 45251 | 1782 | 276 | 529 | 62,05 | 900 | 46543 | 1832 | 278 | 532 |
| 65,50 | 950 | 49129 | 900 47 1934281 | 539 | |
| 68,95 | 1000 | 51715 | 2036 9 0040 | 285 | 545 |
75. 06 06 | 1089 | 56301 | 2217 | 290 | 555 | 9 0045
| 84,64 | 1228 | 63485 | 2499 | 298 | 570 |
| 98,78 | 1433 | 74 091 | 2917 | 310 | 590 |
| 114,6 | 1662 | 85965 | 3384 | 321 | 610 |
| 127,9 | 1854 | 95895 | 3775 | 329 | 625 900 40 |
| 147,3 | 2136 | 110462 | 4349 | 341 | 645 |
| 163,3 | 2369 | 9 0047 1224934823 | 349 | 660 | |
| 186,8 | 2710 | 140 127 | 5517 | 360 | 680 |
| 213,5 | 3096 | 160131 | 6304 | 371 | 700 |
| 222,4 | 3226 | 166829 | 6568 | 374 | 706 |
- Т( o C) = 5/9[T( o F) — 32]
- 1 psi (фунт/дюйм 2 ) = 6894,76 Па (Н/м 2 ) = 0,068948 бар = 51,7149 мм рт.
 ст. = 2,03602 дюйма рт.ст.
ст. = 2,03602 дюйма рт.ст.
См. также Плотность воды, удельный вес и коэффициент теплового расширения, динамическая и кинематическая вязкость, энтальпия и энтропия, теплота парообразования, константа ионизации, pK w , нормальной и тяжелой воды, Давление и Температура кипения, Удельный вес, Удельная теплоемкость (теплоемкость) и Удельный объем для онлайн-калькуляторов, рисунков и таблиц.Кипячение — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1533
- Земля на уровне моря: 101,3 кПа
- Вершина горы Эверест: 33,7 кПа
- Марс (среднее): 0,6 кПа
- Венера (поверхность): 9200 кПа
Кипение – это процесс, при котором жидкость превращается в пар при нагревании до точки кипения. Переход из жидкой фазы в газообразную происходит, когда давление паров жидкости равно атмосферному давлению, действующему на жидкость. Кипение — это физическое изменение, и молекулы не изменяются химически во время процесса.
Кипение — это физическое изменение, и молекулы не изменяются химически во время процесса.
Как происходит кипение?
Когда атомы или молекулы жидкости способны рассредоточиться настолько, чтобы перейти из жидкой фазы в газообразную, образуются пузырьки и происходит кипение.
Рисунок 1: Образование пузырьков в кипящей воде.Видео: Основы кипячения (https://www.youtube.com/embed/Py0GEByCke4).
Температура кипения – это температура, при которой происходит кипение конкретной жидкости. Например, для воды температура кипения составляет 100ºC при давлении 1 атм. Температура кипения жидкости зависит от температуры, атмосферного давления и давления паров жидкости. Когда атмосферное давление сравняется с давлением паров жидкости, начнется кипение.
Жидкость начнет кипеть, когда атмосферное давление = давлению паров жидкости
Упражнение 1.
 Основы кипячения
Основы кипяченияЧто находится внутри пузырьков при кипении жидкости?
Ответ
Пузырьки в кипящей жидкости состоят из молекул жидкости, которые приобрели достаточно энергии, чтобы перейти в газообразное состояние.
Упражнение 2
Опишите образование пузырьков в кипящей жидкости (ответ смотрите в видео).
Температура и кипение
При кипении более энергичные молекулы превращаются в газ, расширяются и образуют пузырьки. Они поднимаются на поверхность и входят в атмосферу. Для перехода из жидкости в газ требуется энергия (см. Энтальпия испарения). Кроме того, молекулы газа, покидающие жидкость, отбирают у жидкости тепловую энергию. Поэтому температура жидкости остается постоянной при кипении. Например, вода при кипячении останется при 100ºC (при давлении 1 атм или 101,3 кПа). График зависимости температуры от времени перехода воды из жидкого состояния в газообразное, называемый кривой нагрева, показывает постоянную температуру, пока вода кипит.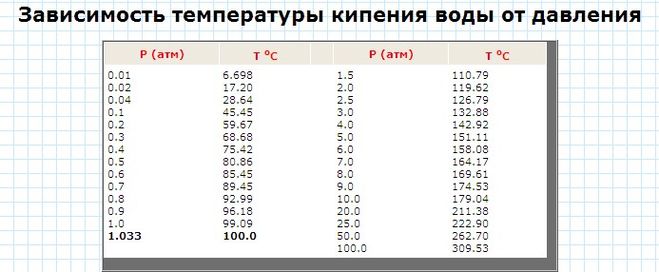
Упражнение 3: Кривая нагрева для воды
Основываясь на приведенной ниже кривой нагрева, когда температура \(H_2O\) превысит 100ºC (в открытой системе)?
Ответ
Температура \(H_2O\) превысит 100 ºC только после того, как он полностью перейдет в газообразную фазу. Пока есть жидкость, температура будет оставаться постоянной.
Атмосферное давление и кипение
Давление газа над жидкостью влияет на температуру кипения. В открытой системе это называется атмосферным давлением. Чем больше давление, тем больше энергии требуется для кипения жидкости и тем выше температура кипения.
Более высокое атмосферное давление = Для кипения требуется больше энергии = Более высокая температура кипения
В открытой системе это можно представить себе как молекулы воздуха, сталкивающиеся с поверхностью жидкости и создающие давление. Это давление передается по всей жидкости и затрудняет образование пузырьков и кипение. Если давление уменьшается, жидкости требуется меньше энергии для перехода в газообразную фазу, и кипение происходит при более низкой температуре.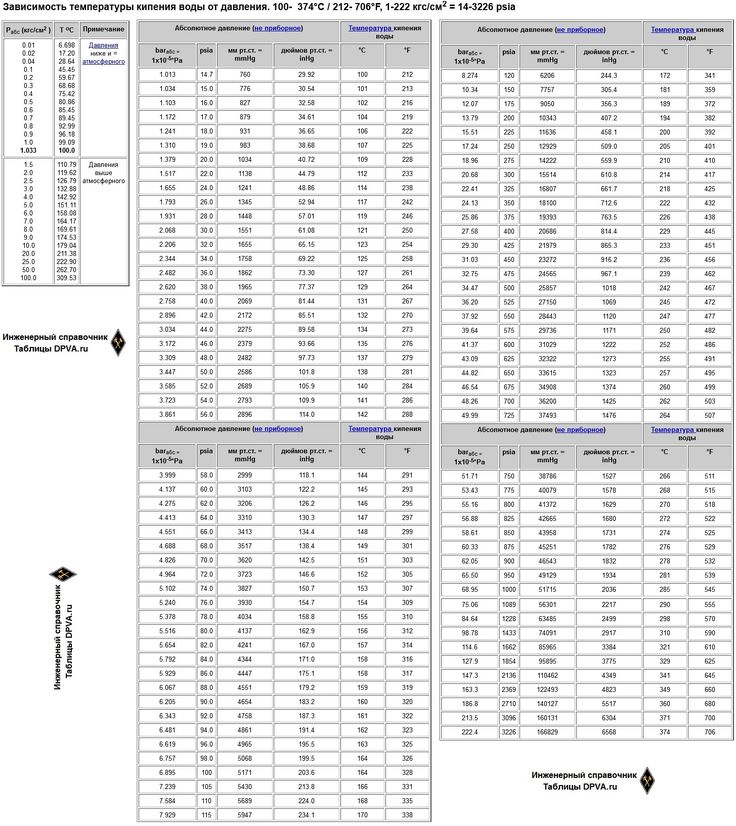
Видео: Атмосферное давление и кипение (www.youtube.com/watch?v=aiwy…ature=youtu.be).
Упражнение 4
На основе атмосферного давления спрогнозируйте температуру кипения воды в следующих местах. Помните, что вода кипит при 100ºC на уровне моря на земле. Предположим, что температура постоянна.
Ответ
Поскольку вода закипает при 100ºC, вода на Марсе закипит быстро (фактическое значение около 10ºC). Температура кипения на Эвересте будет ближе к воде (фактическое значение около 70ºC). На Венере вода кипела бы при температуре выше 100ºC.
Давление пара и кипение
Молекулы, покидающие жидкость в результате испарения, создают восходящее давление при столкновении с молекулами воздуха. Этот восходящий толчок называется давлением пара. Различные вещества имеют разное давление паров и, следовательно, разные температуры кипения. Это происходит из-за различных межмолекулярных сил между молекулами.
Этот восходящий толчок называется давлением пара. Различные вещества имеют разное давление паров и, следовательно, разные температуры кипения. Это происходит из-за различных межмолекулярных сил между молекулами.
Видео: Давление пара и биологическая обработка (youtu.be/ffBusZO-TO0)
Давление пара жидкости снижает давление, оказываемое на жидкость атмосферой. В результате жидкости с высоким давлением пара имеют более низкую температуру кипения. Давление пара можно увеличить, нагревая жидкость и вызывая попадание большего количества молекул в атмосферу. В точке, где давление пара сравняется с атмосферным давлением , начнется кипение. Фактически без какого-либо внешнего давления молекулы жидкости смогут растекаться и переходить из жидкой фазы в газообразную. Газ в виде пузырьков в жидкости будет подниматься на поверхность и выбрасываться в атмосферу.